Vers l’utilisation de nouveaux catalyseurs à base d’argent pour l’industrie pharmaceutique
Plus de 25% des médicaments et 40% des produits agrochimiques contiennent au moins un atome de fluor dans leur structure, principalement sous forme de groupement -CF3 - appelé trifluorométhyle -. Hélas, l’introduction de ces groupements dans ces molécules d’intérêt n’est pas aisée et nécessite l’utilisation de catalyseurs coûteux à base de palladium et de phosphines très sophistiquées. D’où l’intérêt de remplacer ces catalyseurs par des complexes à base d’argent, métal bien plus abondant. Des scientifiques du Laboratoire hétérochimie fondamentale et appliquée (CNRS / Université Paul Sabatier) sont parvenus à leur procurer une réactivité inattendue pour produire ces dérivés fluorés avec d’excellents rendements, dans des conditions douces, et en utilisant l’oxygène de l’air comme oxydant. Ces résultats sont parus dans la revue Chem. Eur. J. (Hot Article).
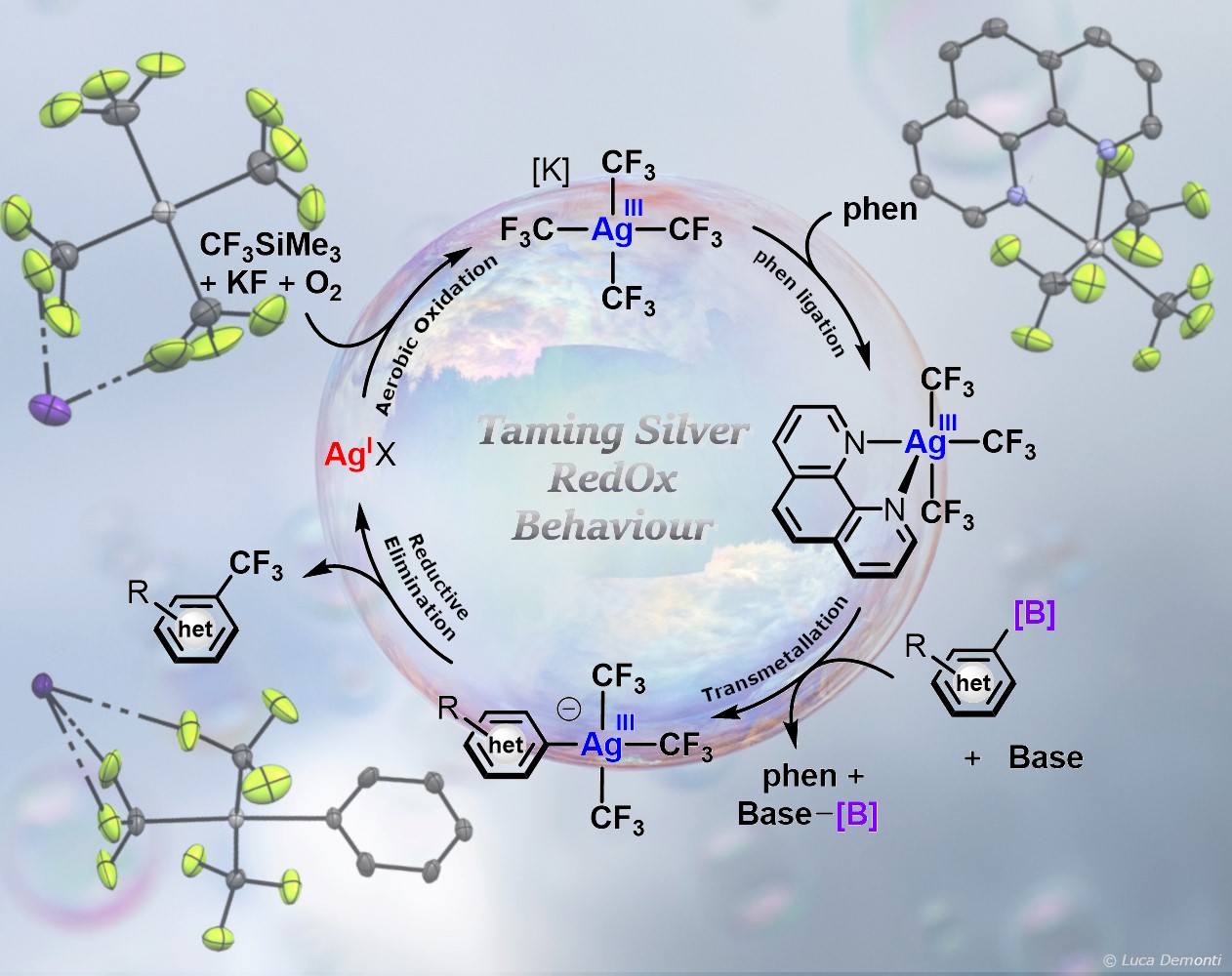
Des nombreuses molécules qui contiennent un groupement trifluorométhyle sont utilisées, par exemple, pour traiter certains types de cancer (Nilutamide, Nilandron®), la polyarthrite rhumatoïde (Léflunomide, Arava®), ou en tant qu’antidépresseur (Fluoxétine, Prozac®). Ces composés organofluorés aryle-CF3 résultent de la transformation directe de dérivés aryle borés (aryle-B(OR)2) (*)- précurseurs abondants, peu chers et facilement utilisables - grâce à une variante atypique de réaction dite « de couplage croisé »(**). Ce type de transformation nécessite habituellement la présence d’un catalyseur à base de palladium (métal précieux et peu abondant) qui rend la production industrielle très coûteuse. Plusieurs méthodes alternatives utilisant comme catalyseurs des complexes à base de cuivre (Cu), moins coûteux, pour le couplage aryle-CF3, ont été développées mais ne sont pas industriellement viables en raison de leur faible efficacité. D’où la proposition d’utiliser cette fois l’argent (Ag) pour jouer ce rôle. En effet, malgré l’inertie chimique bien connue de ce métal, l’Ag est un bon candidat car il présente, sous sa forme oxydée Ag(III), la même structure électronique que les ions Pd(II), Cu(III) et Au(III) déjà identifiés comme intermédiaires réactionnels dans d’autres réactions du même type.
En entourant l’Ag de ligands appropriés, les auteurs ont montré sa capacité à effectuer la trifluorométhylation des dérivés aryle borés, via des intermédiaires réactionnels AgIIICF3 et aryle-AgIII que l’on pensait inaccessibles chimiquement. Mieux encore, ils ont pu remplacer les oxydants forts nécessaires à la réaction, dangereux et coûteux, par de l’air, abondant et générant des sous-produits de réactions non toxiques, et ce malgré son pouvoir oxydant modéré.
Cette nouvelle chimie pourrait conduire au développement de processus catalytiques impliquant des intermédiaires Ag(III), dans des conditions douces, pour obtenir des dérivés aryle-CF3 d’intérêt industriel.
(*) Un aryle est un radical carboné résultant de l'arrachement d'un atome d'hydrogène à un hydrocarbure aromatique.
(**) Le Prix Nobel 2010 a été décerné aux Profs. Akira Suzuki, Richard Heck, et Ei-ichi Negishi pour leurs travaux sur les réactions de couplage croisé permettant l’obtention des aryles fonctionnalisés.
Rédacteur : CCdM
Référence
Luca Demonti, Nathalie Saffon-Merceron, Nicolas Mézailles & Noel Nebra
Cross-coupling through Ag(I)/Ag(III) redox manifold
Chem. Eur. J. 2021