Une nouvelle voie de synthèse pour les molécules naturelles chirales
Beaucoup de molécules naturelles que le chimiste rêve de recréer en laboratoire sont chirales. Elles peuvent exister sous deux formes de même formule chimique mais images l’une de l’autre dans un miroir. Si la nature est capable de synthétiser parfaitement une seule des deux espèces, la plupart des réactions chimiques conduisent à un mélange des deux. Les scientifiques de l’Institut de chimie des substances naturelles (CNRS/Université Paris-Saclay) proposent une nouvelle voie de synthèse, catalysée par un complexe à base d’or, permettant de contrôler parfaitement l’arrangement spatial des molécules obtenues et donc leur chiralité. Résultat qui fait l’objet d’un article dans le J. Am. Chem. Soc..
Recréer en laboratoire des molécules présentes dans le milieu naturel est l’un des objectifs les plus anciens et les plus ambitieux du chimiste organicien. Objectif extrêmement difficile à atteindre car la plupart de ces molécules sont chirales, c’est-à-dire qu’elles peuvent exister sous deux formes, appelées énantiomères, qui partagent une même formule chimique mais dont les structures sont des images l’une de l’autre dans un miroir et non superposables. Si la nature est capable de synthétiser de manière sélective une seule espèce, la plupart des réactions chimiques vont conduire à un mélange des deux énantiomères. C’est très exactement ce que le chimiste cherche à éviter car deux énantiomères peuvent présenter des propriétés biologiques complètement différentes, voire antagonistes, malgré leur apparente similitude.
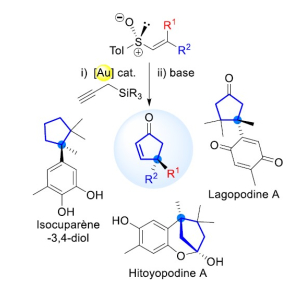
Pour obtenir un seul énantiomère, les scientifiques de l’Institut de chimie des substances naturelles (CNRS/Université Paris-Saclay) proposent une nouvelle voie de synthèse catalysée par un complexe à base d’or, permettant de contrôler parfaitement l’arrangement spatial des molécules obtenues. A partir de substrats chiraux facilement accessibles, ils sont parvenus à produire et isoler, sous forme énantiomériquement pure, plusieurs cyclopenténones, briques moléculaires présentes dans des produits naturels. La synthèse est particulièrement délicate car les produits synthétisés possédent des centres quaternaires, c’est-à-dire des carbones liés à quatre autres atomes de carbone.
La synthèse sous forme énantiomériquement pure de deux molécules naturelles chirales, la lagopodine A et l’hitoyopodine A, que l’on peut extraire de champignons, leur a permis de montrer l’efficacité de cette nouvelle méthode : 7 étapes suffisent maintenant au lieu de 17 auparavant, avec des rendements globaux supérieurs à ceux reportés dans la littérature !
Cette nouvelle méthodologie asymétrique va maintenant permettre aux scientifiques d’évaluer les propriétés antibiotiques et anticancéreuses pressenties pour ces intermédiaires réactionnels et ces produits naturels.
Rédacteur : CCdM
Référence
Weiping Zhou & Arnaud Voituriez
Synthesis of Cyclopentenones with C4-Quaternary Stereocenters via Stereospecific [3,3]-Sigmatropic Rearrangement and Applications in Total Synthesis of Sesquiterpenoids
J. Am. Chem. Soc. 2021