Un nouveau catalyseur plus abondant pour former du dihydrogène à partir de l’eau
Produire du dihydrogène par électrolyse de l’eau nécessite des catalyseurs rares et donc couteux. Ils pourraient être remplacés par un autre catalyseur à base de molybdène, bien plus abondant mais pour l’instant moins efficace. Des scientifiques tentent donc d’élucider son fonctionnement dans le but d’améliorer ses performances.
L’électrolyse de l’eau, qui permet la formation de dihydrogène et de dioxygène à partir d’eau et d’électricité, est des enjeux de la transition énergétique pour la production décarbonée de dihydrogène. Les catalyseurs les plus efficaces sont rares et généralement à base d’un métal peu abondant et cher : le platine. Les remplacer par d’autres systèmes catalytiques est un des défis à relever si l’on veut rendre ce vecteur d’énergie compétitif.
Dans ce contexte, les trisulfures de molybdène (MoS3) sont une alternative attractive car ils montrent une activité catalytique prometteuse, ils sont plus abondants et donc moins coûteux. Hélas, leurs performances sont encore loin d’atteindre celles du platine. D’où la nécessité de comprendre finement la manière dont ils fonctionnent, étape incontournable pour pouvoir espérer les améliorer.
Des équipes du Laboratoire de chimie 5CNRS/ENS de Lyon) et d’IFP Energies nouvelles (IFPEN) ont ainsi mené une étude théorique de nano-catalyseurs amorphes de trisulfures de molybdène (MoS3) supportés sur carbone pour étudier, au cours de leur fonctionnement, leur comportement encore largement méconnu.
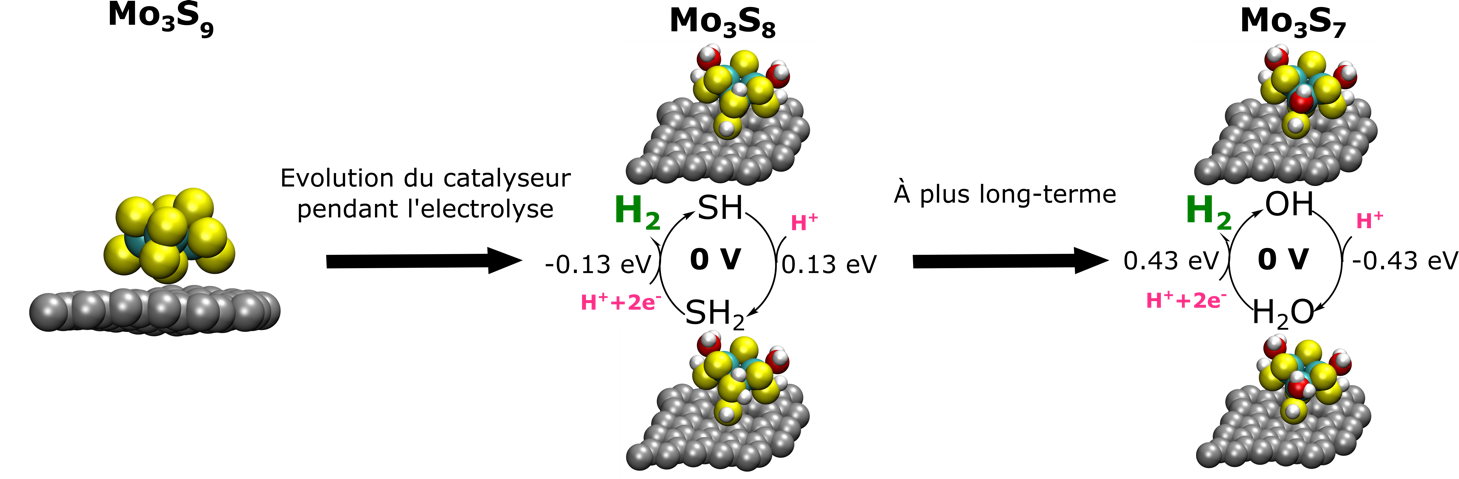
Les nouvelles méthodes de simulation qu’ils ont mises au point pour étudier la stabilité et l’activité en condition d’électrolyse montrent que le catalyseur subit des modifications structurales au cours de la réaction de production du dihydrogène. Une partie des atomes de soufre sont remplacés par des atomes d’oxygène et si ces échanges sont trop importants, le catalyseur perd alors son activité.
En améliorant la modélisation du potentiel électrochimique dans leurs calculs, les scientifiques ont également pu montrer que le mécanisme de la formation de dihydrogène passait par une étape unique de protonation du catalyseur, et non par un transfert couplé d’un proton et d’un électron toujours observé pour les catalyseurs métalliques. Un comportement qui pourrait expliquer l’origine de l’activité de MoS3, et que l’on doit prendre en compte si l’on veut améliorer l’activité catalytique de ces systèmes. Ces résultats sont à retrouver dans la revue ACS Catalysis.
Rédacteur : CCdM
Référence
Nawras Abidi, Amit Sahu, Pascal Raybaud, Stephan Steinmann
Electrochemical potential-dependent stability and activity of MoS3 during the hydrogen evolution reaction
ACS Catalysis 2023
