Rompre la liaison carbone-hydrogène devient un jeu d’enfant
La synthèse d’organosilanes par rupture de liaisons carbone-hydrogène permet d’introduire de manière économique du silicium au sein d’une molécule organique. Opération difficile revisitée par des scientifiques qui proposent une voie de synthèse radicalement nouvelle, à la fois rapide et vertueuse, pour ces composés dont les propriétés trouvent des applications en chimie médicinale ou en science des matériaux.
Situé dans la même période de la classification périodique que le carbone, le silicium partage un certain nombre de propriétés avec ce pilier de la chimie organique, tout en offrant la possibilité d’explorer de nouveaux espaces chimiques lorsqu’il est introduit dans la structure de molécules organiques. En effet, les organosilanes résultants trouvent de nombreuses applications en science des matériaux ou en chimie médicinale où ils sont par exemple utilisés pour moduler les propriétés pharmacocinétiques d’un principe actif.
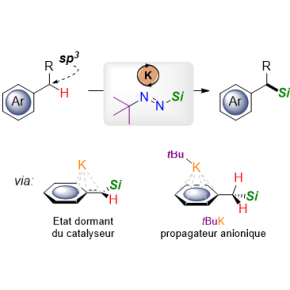
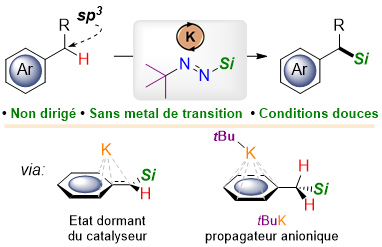
Pour obtenir ces composés, une voie de synthèse envisageable consiste à rompre une liaison carbone-hydrogène pour insérer dans le squelette de la molécule organique l’atome de silicium qui va lui conférer ses nouvelles propriétés. Opération jusqu’à maintenant complexe étant donnée la force et l’ubiquité des liaisons C-H, qui, pour être brisées, nécessitent des procédés peu généraux utilisant des catalyseurs à base de métaux nobles.
Des scientifiques de l’Institut de chimie moléculaire (CNRS/Sorbonne Université) proposent une méthode de synthèse radicalement nouvelle pour introduire du silicium sur une position benzylique, motif carboné que l’on retrouve dans un grand nombre de molécules organiques. L’utilisation d’un tert-butyl-silyldiazène (tBu–N=N–SiR3) combiné à un catalyseur à la fois abondant et bon marché, à base de potassium, permet ainsi la silylation de liaisons carbone-hydrogène dans des dérivés du toluène. Cette approche qui combine économie d’atomes et conditions douces (température ambiante, faible temps de réaction) permet également de s’affranchir des métaux nobles classiquement employés comme catalyseurs dans ce type de réaction, tout en limitant la production de déchets au diazote (N2) et à l’isobutane.
De plus, les études théoriques via des calculs de modélisation moléculaire suggèrent que des espèces hautement réactives du potassium sont impliquées dans le mécanisme réactionnel de silylation. En particulier, le tert-butylpotassium, analogue en termes de réactivité au tert-butyllithium bien connu des chimistes pour sa dangerosité, est proposé comme intermédiaire clef pour expliquer l’activité catalytique.
Cette nouvelle méthodologie de synthèse décrite dans la revue Angewandte Chemie offre une voie d’accès plus rapide et plus vertueuse aux silanes benzyliques.
Rédacteur : CCdM
Référence
Baptiste Neil, Lamine Saadi, Louis Fensterbank & Clément Chauvier
Organopotassium-Catalyzed Silylation of Benzylic C(sp3)‑H Bonds
Angew. Chem. Int. Ed. 2023