RMN et IRM : un duo magnétique pour comprendre les cancers du cerveau
Des chimistes et biologistes du CNRS ont utilisé un modèle de gliome (tumeur cérébrale) de drosophile établi chez l’adulte pour mieux comprendre ce cancer du cerveau. En combinant différentes méthodes originales de résonance magnétique nucléaire (RMN liquide et solide et IRM), ils ont pu élucider les mécanismes biochimiques de ce cancer et confirmer le potentiel thérapeutique d’un récepteur de la sérotonine.
Les gliomes représentent 50 % des cancers du cerveau et constituent les tumeurs cérébrales les plus fréquentes. Les altérations moléculaires impliquées dans ces cancers affectent principalement les récepteurs membranaires à activité tyrosine kinase, qui agissent comme des « interrupteurs » d'activation ou d'inhibition de nombreuses fonctions comme la division ou la migration cellulaire. En particulier, on observe une amplification et/ou des mutations du récepteur du facteur de croissance épidermique (EGFR) et des voies de signalisation qui lui sont associées. Ceci induit une division cellulaire incontrôlée et, à terme, l’apparition de tumeurs. Plusieurs thérapies ciblées ont été développées, mais les traitements actuels restent inefficaces contre les glioblastomes, les formes les plus graves de ces cancers du cerveau. Il est donc primordial d’identifier de nouvelles cibles thérapeutiques pour traiter ces cancers.
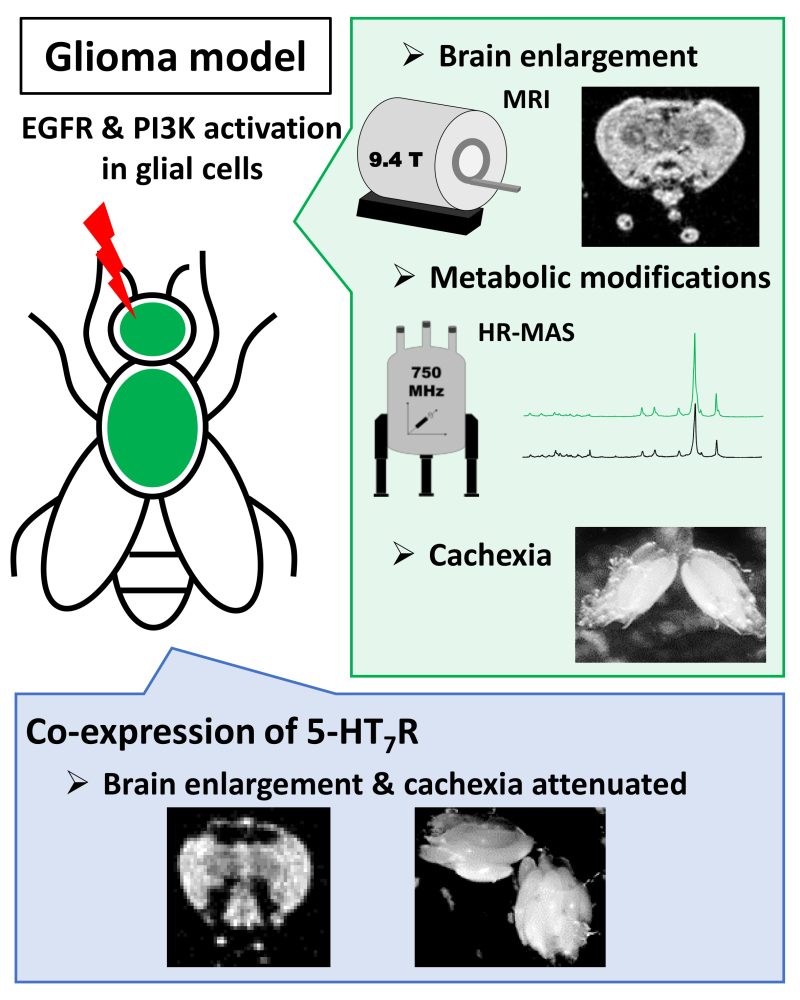
Des scientifiques du CNRS, au Centre de biophysique moléculaire et au laboratoire Conditions extrêmes et matériaux haute température et irradiation, ont étudié un modèle de ces cancers du cerveau chez la drosophile pour mieux comprendre les perturbations métaboliques qui lui sont associées. La surexpression des récepteurs de l’EGF et d’une enzyme (la phosphoinositide 3-kinase, PI3K) dans les cellules gliales, ces cellules du système nerveux central qui soutiennent et protègent les neurones, induit une hypertrophie du cerveau nettement visible par IRM et l’apparition d’une cachexie (fonte du tissu adipeux et des muscles). Ils ont ensuite exploré l’altération du métabolisme cellulaire en utilisant la RMN à angle magique haute résolution (HR-MAS) et la RMN liquide 2D. Ils ont ainsi pu mettre en évidence des modifications des voies métaboliques dans le gliome, en particulier des modifications caractéristiques de la cachexie.
Si l’intérêt de cibler le récepteur 5-HT7 de la sérotonine pour le traitement de maladies neurologiques et psychiatriques est bien décrit, son rôle dans le contrôle de la prolifération tumorale reste peu exploré. Pour tenter de répondre à cette question, les scientifiques ont génétiquement modifié les drosophiles porteuses du gliome pour qu'elles expriment à la surface des cellules gliales le récepteur R5-HT7 humain. Ils ont ainsi pu montrer que l'expression de ce récepteur de la sérotonine atténue plusieurs effets qui sont associés au développement du gliome, comme l'hypertrophie du cerveau, observable par IRM, et la cachexie.
La combinaison des techniques d’analyses RMN utilisées ici, décrite dans The Faseb Journal, se révèle être un outil efficace pour mieux comprendre les mécanismes biochimiques de certains cancers du cerveau, étape cruciale pour développer de nouvelles thérapies ciblées.
Rédacteur: AVR
Référence
An adult Drosophila glioma model to highlight metabolic dysfunctions and evaluate the role of the serotonin 5-HT7 receptor as a potential therapeutic target
Marylène Bertrand, Frédéric Szeremeta, Nadège Hervouet-Coste, Vincent Sarou-Kanian, Céline Landon, Séverine Morisset-Lopez & Martine Decoville
The Faseb Journal 2023
DOI: 10.1096/fj.202300783RR