Quand la catalyse au palladium plonge dans l’alcool pour se mettre au vert
Remplacer les solvants polluants utilisés massivement dans l’industrie chimique par d’autres plus vertueux ? C’est maintenant possible grâce à une collaboration entre le LIT (CNRS/Université de Strasbourg) et le LBM (CNRS/ Sorbonne Université, ENS, PSL University). Les équipes ont en effet réalisé pour la première fois la formation in situ, dans des solvants purement alcooliques, d’un pré-catalyseur à base de palladium qui active la formation de la liaison carbone-azote, réaction très courante en chimie organique. Les résultats sont à retrouver dans la revue ACS Catalysis.
La synthèse industrielle de composés organiques implique l’utilisation massive de solvants majoritairement issus des ressources pétrolières. L’industrie pharmaceutique a récemment établi un classement des solvants selon des critères d’environnement, de santé ou de sécurité. Il montre que parmi les solvants classiquement utilisés en synthèse organique (toluène, tétrahydrofurane(THF), diméthylformamide(DMF)…), les solvants protiques polaires comme l’eau ou les alcools sont les plus vertueux.
La réaction de Buchwald-Hartwig fait partie des vingt réactions les plus utilisées dans l‘industrie pharmaceutique. Elle permet la formation de liaisons carbone-azote, mais hélas elle utilise comme solvant un mélange THF/DMF écologiquement discutable.
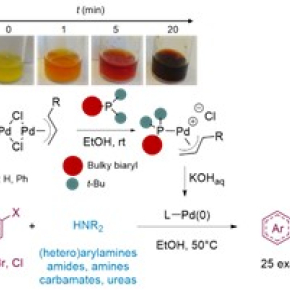
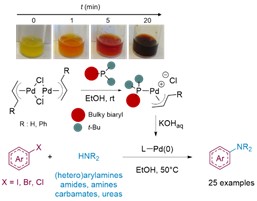
Depuis plusieurs années, une équipe du Laboratoire d’innovation thérapeutique (CNRS/Université de Strasbourg) cherche des solvants alternatifs pour cette réaction catalysée par un complexe de palladium. En partant d’un nouveau catalyseur (de formule chimique [Pd(p-allyl)Cl]2/t-BuXPhos), les équipes ont montré que la réaction pouvait parfaitement se dérouler dans des solvants alcooliques simples tels que l’éthanol ou le propanol, conduisant au couplage entre atomes de carbone et atomes d’azote d’une large variété de composés : amines, amides, urées… L’étude plus approfondie du mécanisme de la réaction a montré que l’alcool utilisé comme solvant jouait un rôle prépondérant dans la formation de l’espèce catalytiquement active. En effet, en milieu alcoolique, le composé [Pd(p-allyl)Cl]2 réagit spontanément avec le t-BuXPhos pour former un nouveau catalyseur particulièrement efficace de type [Pd(p-allyl)(L)]Cl (voir figure), réaction spontanée qui n’a pas lieu dans les solvants organiques habituels.
Résultats qui proposent donc une alternative économique et écoresponsable par rapport aux solvants organiques traditionnels, à retrouver dans la revue ACS Catal.
Rédacteur : CCdM
Référence
Steinsoultz P., Bailly A., Wagner P., Oliva E., Schmitt M., Grimaud L. & Bihel F.
In Situ Formation of Cationic π-Allylpalladium Precatalysts in Alcoholic Solvents: Application to C–N Bond Formation
ACS Catal. 2021
DOI: 10.1021/acscatal.1c04641.