Pourquoi la métallation au lithium est-elle si gourmande en réactifs?
L’ortholithiation, réaction très utilisée lors de la synthèse de nombreux produits pharmaceutiques ou agrochimiques, consomme plus de lithium que ce que prévoit la théorie. Les scientifiques des laboratoires de Chimie organique, bioorganique, réactivité et analyse (CNRS/Université de Rouen/INSA Rouen) et Institut Lavoisier de Versailles (CNRS/Université Paris-Saclay/UVSQ) identifient pour la première fois les agrégats à l’origine de ce phénomène. Ces résultats sont à retrouver dans la revue Angew. Chemie. Int. Ed.
Découverte par Georg Wittig et Henry Gilman en 1939, l’orthométallation est une réaction qui permet d’introduire facilement des nouveaux groupements fonctionnels sur un cycle aromatique. A l’échelle industrielle, cette réaction est fondamentale car on retrouve ces structures dans une large gamme de produits pharmaceutiques ou de composés utilisés en agrochimie.
Dans le cas de l’ortholithiation, les chimistes utilisent le n-butyllithium (BuLi) pour arracher un proton (H) au cycle aromatique de manière à le remplacer ensuite par un substituant choisi qui confèrera ses propriétés au produit obtenu. Si, en théorie, chaque BuLi est susceptible de remplacer un proton par un atome de lithium, les expériences montrent que cette réaction consomme au moins deux, et parfois jusqu’à cinq équivalents de BuLi pour que la transformation soit efficace. Réaction bien trop gourmande en réactifs… D’où la question à laquelle les scientifiques du Laboratoire de chimie organique, bioorganique, réactivité et analyse (CNRS/Université de Rouen/INSA Rouen) apportent aujourd’hui des éléments de réponse : pourquoi cette réaction nécessite-t-elle un tel excès de BuLi?
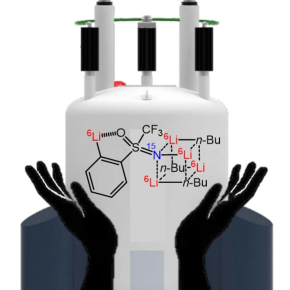
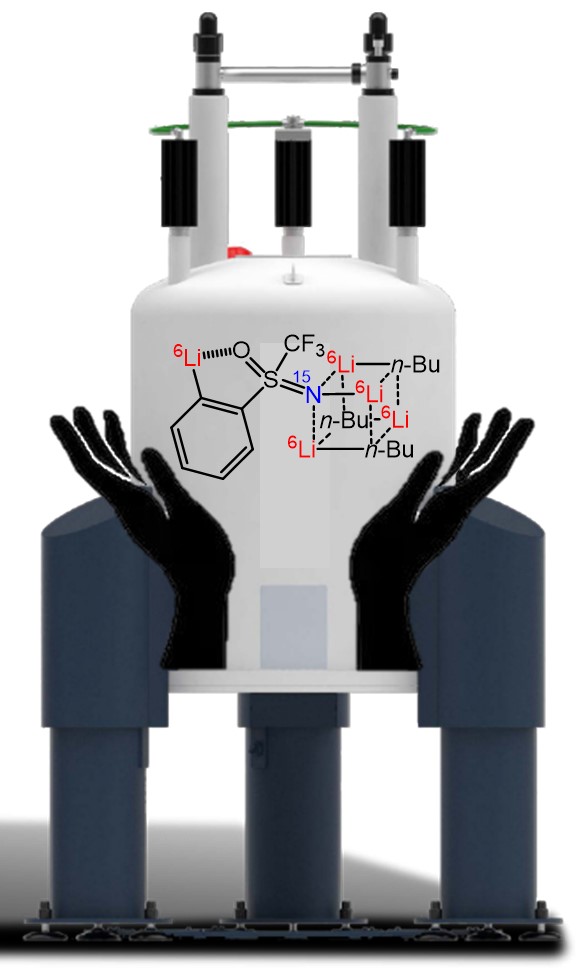
En combinant des expériences de RMN, un marquage isotopique et des calculs de théorie fonctionnelle de la densité, les chercheurs ont montré qu’au cours de la réaction, l’aryllithien obtenu s’agrège à l’excès de BuLi pour former des complexes qui deviennent les vraies espèces réactives. C’est dans ces intermédiaires que l’excès de BuLi se trouve capturé, expliquant que la réaction ne peut se poursuivre que lorsque suffisamment de BuLi libre est apporté au milieu réactionnel. Les auteurs montrent également la grande diversité structurale de ces agrégats au fil de l’addition de BuLi.
Que faire donc pour éviter la formation de ces agrégats qui consomment une partie du réactif nécessaire ? Modifier la composition de ces agrégats grâce à des additifs lithiés qui prendrait la place du BuLi et restaurerait sa fonction de base, travailler dans une configuration d’écoulement permanent pour éviter leur formation, des pistes que les chimistes ont déjà commencé à explorer…
Rédacteur : CCdM
Référence
Matthieu Hédouin, Anne-Laure Barthelemy, Nicolas Vanthuyne, Hend Besrour, Jacques Maddaluno, Emmanuel Magnier & Hassan Oulyadi
NMR and DFT Studies with a Doubly Labelled 15N/6Li STrifluoromethyl Sulfoximine Reveal Why a Directed ortho-Lithiation Requires an Excess of n-BuLi
Angewandte Chemie International Edition 2022