Modifier la réactivité de l’indole pour découvrir de nouveaux médicaments
Central en chimie pharmaceutique, l’indole ne se lie naturellement qu’aux molécules en manque d’électrons. Afin de pouvoir explorer davantage de combinaisons pour de nouveaux médicaments, des chercheurs de l’ICMMO (CNRS/Université Paris-Saclay) et de l’ICSN (CNRS) ont développé une méthode, basée sur l’utilisation d’un superacide, qui rend l’indole susceptible de réagir avec des composés riches en électrons. Publiés dans Angewandte Chemie International Edition, ces travaux aboutiront au dépôt de plusieurs molécules inédites à la chimiothèque nationale.
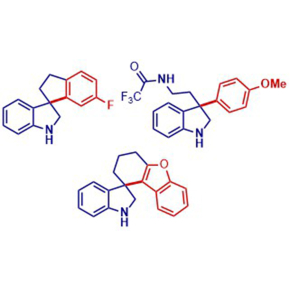
L’indole est un composé bicyclique aromatique, c’est-à-dire fait de deux cycles plans de carbone et d’hydrogène comportant en plus un atome d’azote. On retrouve cette structure dans de nombreux médicaments comme l’anticancéreux vinblastine. Le développement de nouvelles molécules incorporant un indole est cependant freiné par le fait que l’indole réagit principalement avec des composés électrophiles, en manque d’électrons, au détriment de tous les autres composés. Cela l’empêche notamment de se lier aux dérivés du benzène, nombreux en chimie organique, ce qui permettrait de synthétiser de nouvelles molécules potentiellement thérapeutiques. Des chercheurs de l’Institut de chimie moléculaire et des matériaux d’Orsay (ICMMO, CNRS/Université Paris-Saclay) et de l’Institut de chimie des substances naturelles (ICSN, CNRS) ont mis au point une méthode simple pour forcer l’indole à réagir avec des molécules nucléophiles, riches en électrons.
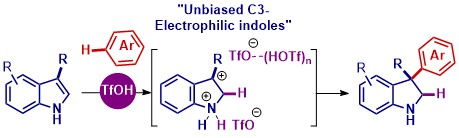
Alors que les approches actuelles passent par une modification en amont de l’indole, les chercheurs ont utilisé l’indole tel quel, mais dans un milieu fortement chargé en acide triflique, plus puissant que l’acide sulfurique. L’indole peut alors quitter sa structure plane et former des molécules tridimensionnelles. Ces structures tridimensionnelles ont statistiquement plus de probabilités de trouver des applications dans le domaine de la santé que celles qui restent en 2D. Les molécules obtenues seront déposées à la chimiothèque nationale, où elles seront accessibles à toutes les équipes académiques qui souhaiteraient en tester les propriétés. Les chercheurs tentent à présent de rendre ces réactions énantiosélectives, c’est-à-dire de n’obtenir que l’énantiomère qui présente les propriétés désirées. En effet, ces molécules 3D sont pour le moment obtenues sous forme d’un mélange racémique, c’est-à-dire qu’elles produisent deux énantiomères (deux composés similaires images l’un de l’autre) dans un ratio de 1 :1. Cela faciliterait l’exploration des nouvelles molécules qu’il sera possible de synthétiser grâce à ces travaux.
Rédacteur : CCdM
Référence
Nazarii Sabat, Weiping Zhou, Vincent Gandon, Xavier Guinchard & Guillaume Vincent
Unbiased C3-Electrophilic Indoles: Triflic Acid Mediated C3-Regioselective Hydroarylation of N-H Indoles
Angew. Chemie Int. Ed. 2022
https://onlinelibrary.wiley.com/doi/full/10.1002/anie.202204400