LIPAGG, un projet européen pour mieux comprendre la formation des fibres amyloïdes
Les protéines amyloïdes, à l’origine de pathologies répandues comme la maladie d’Alzheimer, la maladie de Parkinson et le diabète de type 2, cachent encore de nombreux secrets. Le mécanisme d’endommagement cellulaire induit par les protéines amyloïdes est au cœur de LIPAGG, un nouveau projet collaboratif permettant de financer 15 thèses de recherche doctorale par le programme-cadre Horizon Europe.
Avec environ 14 millions de personnes touchées par la maladie d'Alzheimer, 1,2 million par la maladie de Parkinson et 60 millions par le diabète de type 2, ces trois maladies sont particulièrement répandues en Europe – et il n’existe actuellement aucun traitement curatif. Leur point commun : elles sont causées par le dysfonctionnement de protéines qui ont la capacité de s’agréger et de former des structures oligomériques et fibrillaires. C’est à ce processus d’agrégation que s’intéressent Lucie Khemtemourian, directrice de recherche CNRS au laboratoire Chimie et biologie des membranes et des nanoobjets (CBMN)1 , et le consortium de 23 partenaires répartis dans 6 pays de l’UE qu’elle coordonne dans le cadre d’un nouveau projet financé par Horizon Europe, baptisé LIPAGG2 .

Les lipides au cœur de l’enquête
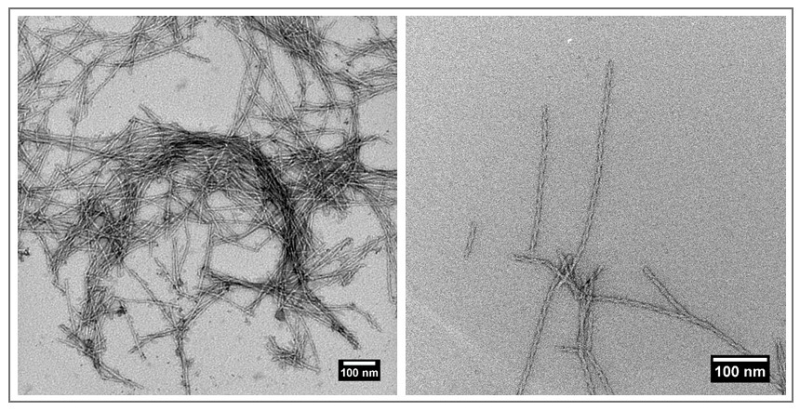
« Les protéines Aβ, α-synucléine, et IAPP (islet amyloid polypeptide), liées respectivement à la maladie d’Alzheimer, la maladie de Parkinson, et au diabète de type 2, sont naturellement présentes dans le corps humain : dans le cerveau pour les deux premières et dans le pancréas pour la troisième », détaille la chercheuse bordelaise. Sous forme de monomères, c’est-à-dire seuls, elles ne sont pas toxiques. Toutefois, lorsqu’elles commencent à s’agréger, la pathologie survient. Lucie Khemtemourian compare ce mécanisme d’agrégation à un jeu de construction bien connu : « Les protéines monomères sont comme des pièces de Lego individuelles. Quand elles s’emboîtent, elles forment des oligomères, puis des fibres amyloïdes. Une fois à l’interface des membranes cellulaires, ces agrégats peuvent induire la mort de la cellule. » « Alors que d'autres chercheurs pensent que la protéine est la seule cause de la mort cellulaire, notre projet identifie un deuxième facteur contribuant à la toxicité de la protéine : les lipides », complète Carmelo La Rosa, professeur à l’Université de Catalane en Italie et pionnier de l’hypothèse LipAgg.
Elaborée par un consortium créé dès 2020 lors d’un congrès avec des collègues italiens, français, danois et allemands, cette piste propose que les lipides, principal composant de la membrane cellulaire, joueraient un rôle crucial dans la formation des fibres amyloïdes. « Certains lipides semblent servir de point d’ancrage pour les monomères, puis par la suite accélèrent la formation des fibres », constate Lucie Khemtemourian. « Nous ne savons pas encore pourquoi, mais le complexe lipide-protéine amyloïde pourrait être potentiellement plus toxique que les protéines seules. C’est ce que nous cherchons à élucider. »
La quête d’un financement européen
Le chemin vers le financement européen est néanmoins semé d’embûches. Après le dépôt infructueux d’un projet FET Open dans le cadre du programme Horizon 2020, prédécesseur d’Horizon Europe, puis d’un projet EIC Pathfinder davantage axé sur l’innovation, le consortium décide de s’agrandir et de déposer un projet Marie Skłodowska-Curie Actions (MSCA) Doctoral Networks, un dispositif qui permet le financement de 15 thèses.
Une première candidature, en 2023, regroupe neuf équipes italiennes, allemandes, danoises, suédoises et françaises, ainsi que onze partenaires non-académiques. « La force de notre consortium réside dans l’association d’équipes de recherche aux spécialités complémentaires », avance Lucie Khemtemourian. « Nous rassemblons majoritairement des biophysiciens, mais également des biologistes pour mieux comprendre ce qui se passe au niveau cellulaire, et des chimistes, dont le rôle est de synthétiser des molécules qui inhibent la formation des fibres amyloïdes. » Ces équipes disposent de techniques et d’infrastructures de pointe telles que la cryo-microscopie et la résonance magnétique nucléaire (RMN), ainsi que la fluorescence, la spectroscopie infrarouge à transformée de Fourier et les superordinateurs pour réaliser des expériences de dynamique moléculaire.
Cette tentative échoue de peu et convainc les chercheurs de retenter leur chance en 2024, accompagnés de l’ingénieure de projet européen (IPE)1 Cécile Bacles. La participation de partenaires non-académiques représente également une excellente opportunité pour les doctorants du projet : elle permet de comprendre la traduction concrète de la recherche fondamentale en innovation dans les domaines des biotechnologies et de la pharmaceutique, mais aussi de développer une recherche participative qui inclut les patients à chaque étape. Finalement, le projet LIPAGG est accepté à l’appel 2024. « Nous sommes très heureux d’y être arrivés cette fois-ci », se réjouit Lucie Khemtemourian. « Ce projet s’appuie sur une hypothèse intéressante, mais aussi sur un consortium solide, où tout le monde se connaît et où il n’y a pas de mésentente. » Autant de facteurs qui auront contribué à cette réussite à l’appel MSCA Doctoral Networks. Le projet LIPAGG débutera en mars 2026 et sera financé pour quatre ans à hauteur de 4,6 millions d’euros.
Rédacteur : CD
- 1Support local proposé par le CNRS pour aider au montage des projets européens en coordination CNRS
Recrutement
Le consortium recherche un·e Manager de Projets Européens pour la coordination administrative du projet européen LIPAGG. Pour plus de renseignements, rendez-vous sur le Portail Emploi du CNRS. Date limite de candidature : 3 novembre 2025.
