Ligation chimique : l’outil de synthèse des protéines du futur
Pourrait-on fabriquer des protéines polyfonctionnelles qui seraient les nouveaux biomédicaments de demain ? C’est ce que nous promet la ligation chimique catalysée par des enzymes. Vladimir Torbéev, directeur de recherche à l’Institut de science et d’ingénierie supramoléculaires (ISIS, CNRS), présente cette voie de synthèse des protéines en plein essor.
Qu’est-ce que la ligation chimique?
La ligation chimique s’appuie sur les méthodes de synthèse organique pour préparer des peptides courts et les attacher ensuite entre eux pour obtenir de plus grandes molécules. On peut ainsi élaborer des enchaînements composés de plusieurs centaines d’unités. Le repli de ces polypeptides produit des protéines de petite à moyenne taille. Le défi des chimistes à présent ? Synthétiser de plus grandes protéines et, pourquoi pas, porteuses de nouvelles fonctions. Ce domaine de la conception et synthèse de protéines est en plein essor.
En quoi est-elle prometteuse pour faire des protéines ?
Pouvoir fabriquer à volonté de nouvelles protéines pour en faire des biomédicaments (anticorps) ou reproduire des protéines naturelles pour en étudier le fonctionnement dans diverses conditions (comment elles adoptent leur forme 3D, s'auto-assemblent, catalysent des réactions, interagissent et transportent d'autres molécules dans les cellules, …) : voilà le rêve de nombreux scientifiques. Pour cela, il faut pouvoir modifier ou marquer les protéines en y introduisant, par exemple, des acides aminés avec des fragments qui peuvent être visibles par les techniques de spectroscopies classiques de la chimie.
Si les biotechnologies permettent de fabriquer des protéines naturelles de façon très efficaces, elles ne permettent pas d’introduire des fonctions non conventionnelles dans l’enchaînement de peptides, ni d’inventer de nouvelles protéines. Pour cela, la ligation de peptides courts porteurs des marqueurs ou fonctions désirées est très prometteuse.
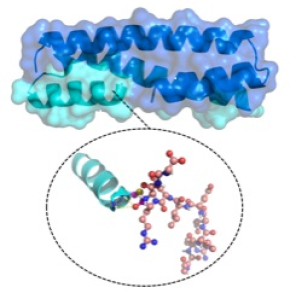
Catalysée par des enzymes, la ligation chimique permettrait de booster l’élaboration des protéines ?
Comme beaucoup de réactions chimiques, la ligation des peptides courts peut être largement aidée par un catalyseur. Des chercheuses et chercheurs d’Université de Strasbourg, du CNRS, de l’INSERM et de l’Université de Californie à San Francisco ont récemment mis au point un enzyme artificiel (sorte de protéine) qui aide cette ligation et permet de produire des protéines semblables à celles qui existent naturellement ou totalement nouvelles. Dans une étude publiée dans JACS, ils démontrent l’activité catalytique de cet enzyme spécialement conçu pour la ligation des peptides. Leurs efforts se concentrent à présent sur comment booster son efficacité catalytique pour la synthèse de nouvelles protéines.
Référence
Acyl Transfer Catalytic Activity in De Novo Designed Protein with N‑Terminus of α‑Helix As Oxyanion-Binding Site Elise A. Naudin, Alastair G. McEwen, Sophia K. Tan, Pierre Poussin-Courmontagne, Jean-Louis Schmitt, Catherine Birck, William F. DeGrado et Vladimir Torbeev, JACS 26 février 2021.