Mieux comprendre la résistance bactérienne aux antibiotiques grâce à la RMN
La propagation rapide de la résistance aux antibiotiques parmi les pathogènes bactériens est un problème majeur de santé publique. Dans un article publié dans le Journal of the American Chemical Society, des scientifiques montrent comment la résonance magnétique nucléaire (RMN) se révèle être un outil analytique puissant pour mieux suivre le devenir des antibiotiques face aux phénomènes de résistance et potentiellement aider à les rendre plus efficaces.
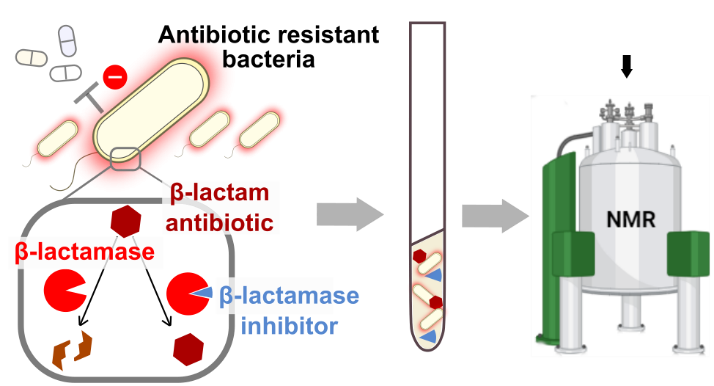
Le rôle des antibiotiques est d’éliminer les cellules bactériennes ou de limiter leur croissance. Cependant, leur utilisation massive crée ce que l’on appelle une « pression de sélection » favorisant ainsi l'émergence de souches résistantes. En présence d’un antibiotique, seules survivent les bactéries dotées de mécanismes de défense spécifiques. En éliminant les bactéries sensibles, l'antibiotique crée un environnement propice à la prolifération des souches capables de lui résister. L ’antibio-résistance, problème majeur de santé publique, est alors accentuée par la dissémination des antibiotiques et des bactéries résistantes dans l'environnement posant ainsi un risque sérieux pour l'efficacité et la durabilité des traitements disponibles.
La production d’enzymes appelées β-lactamases constitue un des principaux indicateurs cliniques de l'émergence de la résistance chez de nombreuses bactéries. Ces β-lactamases ont la capacité de dégrader les antibiotiques β-lactames* les rendant ainsi inactifs. Produites par la bactérie dans son périplasme, un compartiment délimité par ses membranes internes et externes, ces enzymes renforcent la défense de la bactérie contre l'intrusion des antibiotiques. Des scientifiques de l’Institut de biologie structurale (CNRS/CEA/Université Grenoble Alpes) ont donc développé une méthode de suivi in situ par résonance magnétique nucléaire de l'activité enzymatique se déroulant dans la cellule. Cette approche leur a permis d’analyser en temps réel la dégradation des β-lactames par les β-lactamases dans des souches résistantes. En utilisant des inhibiteurs spécifiques des enzymes β-lactamases, ils ont évalué leur capacité à franchir la membrane externe, à interagir avec leur cible et finalement à bloquer au moins partiellement la dégradation des antibiotiques. Ces mesures permettent d’obtenir des informations sur la nature et la localisation de ces interactions entre les inhibiteurs et les enzymes, en les mesurant directement au sein de la cellule.
Cette étude, parue dans le J. Am. Chem. Soc., montre que la RMN sur cellule vivante constitue un outil analytique puissant pour l'étude de nouvelles molécules ciblant spécifiquement les composants moléculaires du périplasme bactérien responsables de l’antibio-résistance. Une approche qui va permettre d'évaluer l'efficacité des médicaments directement dans leur environnement, ouvrant pourquoi-pas là voie à une médecine personnalisée en proposant une antibiothérapie spécifique pour chaque patient en fonction du micro-organisme responsable de l’infection résistante.
* Les antibiotiques de type β-lactame appartiennent à une grande famille connue pour bloquer l’activité des PBPs (Penicillin Binding Proteins) et comprennent entre autres les dérivés de la pénicilline, les céphalosporines, les monobactames et les carbapénèmes.
Rédacteur : CCdM
Référence
Alicja Razew, Quentin Herail, Mayara Miyachiro, Constantin Anoyatis-Pelé, Catherine Bougault, Andrea Dessen, Michel Arthur & Jean-Pierre Simorre
Monitoring Drug−Protein Interactions in the Bacterial Periplasm by Solution Nuclear Magnetic Resonance Spectroscopy
J. Am. Chem. Soc. 2024