Du nouveau dans la réaction de Diels-Alder grâce aux organocatalyseurs
Il est important de développer des stratégies de synthèse de médicaments et autres molécules complexes qui se passent de catalyseurs à base de métaux précieux et souvent toxiques. Dans un article paru dans le Journal of American Chemical Society, des chimistes du CNRS spécialistes de l’organocatalyse revisitent la célèbre réaction de Diels-Alder pour former un large éventail de molécules d’intérêt pharmaceutique.
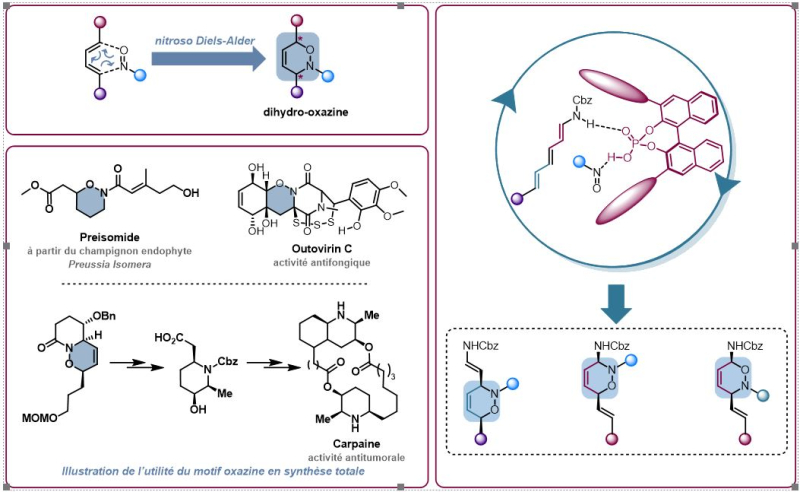
Depuis le prix Nobel décerné à Benjamin List et David MacMillan en 2021 pour leurs travaux en organocatalyse, la réputation de ce domaine de recherche n’est plus à faire. Petites molécules carbonées, les organocatalyseurs ont séduit de nombreux chimistes organiciens en mal d’alternatives efficaces aux métaux largement utilisés, mais souvent connus pour leur toxicité et leur coût élevé. Ils permettent non seulement d‘accélérer certaines réactions mais aussi et surtout de contrôler la géométrie des molécules synthétisées. Parmi le large champ d’applications de l’organocatalyse, la réaction de Diels-Alder est un cas d’école. Transformation iconique en chimie organique, elle permet la synthèse de molécules cycliques en transformant, en une seule étape, deux doubles liaisons C=C en simples liaisons C-C. Au cours de cette réaction dite de cycloaddition, plusieurs isomères peuvent souvent se former, molécules de même formule chimique mais dont l’arrangement des atomes dans l’espace diffère. On appelle stéréosélectivité l’art de contrôler cette géométrie et l’utilisation d’un organocatalyseur chiral est un puissant levier pour atteindre ce contrôle.
Une équipe de chimistes de l’Institut des substances naturelles (CNRS/Université Paris Saclay) a étudié une famille de tels organocatalyseurs chiraux à base d’acide phosphorique. Avec ces catalyseurs, ils ont pu réaliser des réactions de Diels-Alder asymétriques qui permettent d’introduire dans le cycle une liaison N-O. Les molécules ainsi obtenues, appelées oxazines, sont des hétérocycles à 6 atomes dont 4 de carbone, un atome d’azote et un atome d’oxygène. Ces molécules, que l’on retrouve dans de nombreux produits naturels comme le Preisomide aux propriété antimicrobiennes, présentent un grand intérêt, notamment en chimie thérapeutique. Comme il est aisé de jouer sur la liaison N-O, elles sont des briques de choix pour la préparation rapide de produits plus complexes.
D’habitude, les cycloadditions de Diels-Alder utilisent comme réactifs de départ des molécules qui possèdent deux doubles liaisons consécutives, appelés diènes. Des chimistes de l’ICSN se sont penchés sur une question simple mais pourtant jamais étudiée jusqu’ici : qu’advient-il si ces réactifs possèdent non pas deux mais trois doubles liaisons (triènes) ? Sur quel couple de liaisons se fait la cycloaddition? L’organocatalyseur parvient-il à différencier ces trois doubles liaisons tout en conservant la stéréosélectivité de la réaction ? Leur étude montre que le catalyseur fonctionne toujours et conserve le contrôle sur la géométrie de la molécule produite. Plus puissant encore, cette sélectivité est modulable en jouant sur les paramètres de la synthèse pour choisir quelle géométrie de cycle se forme. Ainsi, parmi les 8 isomères possibles en partant d’un triène, 6 oxazines différentes ont pu être synthétisées de façon très sélective. Les scientifiques ont illustré l’utilité de ces oxazines en proposant un éventail varié de produits issus de ces intermédiaires. Amino-alcools, tricycles originaux, oxazines fonctionnalisées sont venus soutenir ce travail aujourd’hui publié dans le Journal of American Chemical Society.
Rédacteur: AVR
Référence
Enantioselective and Regiodivergent Synthesis of Dihydro-1,2-oxazines from Triene-Carbamates via Chiral Phosphoric Acid-Catalysis
Emma Naulin, Marine Lombard, Vincent Gandon, Pascal Retailleau, Elsa Van Elslande, Luc Neuville & Géraldine Masson
Journal of the American Chemical Society 2023
https://doi.org/10.1021/jacs.3c12015
