Décrypter les GAGs : une nouvelle voie de séquençage de polysaccharides
Le séquençage des polysaccharides est très en retard comparé à d’autres grandes familles de biopolymères comme l’ADN. Dans une étude parue dans la revue Nature Communications, des scientifiques proposent une approche efficace et robuste basée sur le passage à travers des nanopores protéiques pour décrypter la structure de polysaccharides bioactifs complexes, les GAGs.
Le séquençage est une technique d’analyse qui permet de remonter à l’enchaînement exact des briques constitutives d’un biopolymère. Si de nombreuses méthodes de lecture et d’analyse structurales ont été mises au point pour l’ADN ou diverse protéines, le séquençage des polysaccharides, de la famille des glucides, est quant à lui très en retard. Décrypter la structure exacte de certains polysaccharides bioactifs, et parmi eux les glycosaminoglycanes (GAGs) exprimés à la surface des cellules et dans la matrice extracellulaire où ils jouent un rôle central dans la communication des cellules avec leur environnement, s’avère pourtant essentiel. Les GAGs sont des polysaccharides linéaires fortement anioniques, sulfatés pour la plupart, et constitués d'unités disaccharidiques. Ils présentent une extraordinaire complexité structurale de part les combinaisons innombrables de ces unités, ce qui rend les méthodes bio-structurales conventionnelles peu efficaces.
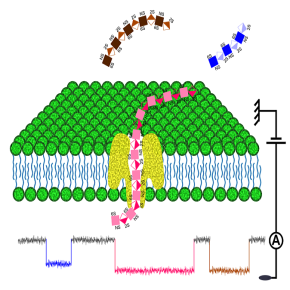
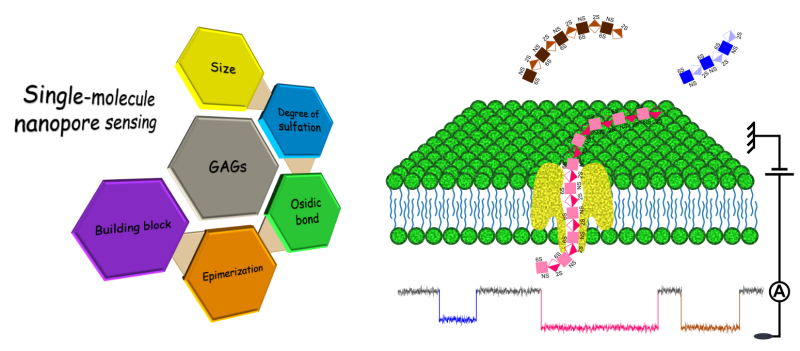
Dans ce contexte, une équipe du Laboratoire analyse, modélisation, matériaux pour la biologie et l'environnement (LAMBE, CNRS/Université Paris-Saclay, Univ. Evry) propose une approche innovante qui exploite les propriétés de confinement et de translocation de biomolécules individuelles à travers des nanopores de nature protéique. Le principe de détection et d’analyse structurale par nanopore repose sur la mesure du courant ionique entre deux chambres soumises à une tension et séparées par une membrane lipidique. Un courant ne peut être mesuré que lorsque qu’un pore nanométrique traverse la membrane et relie les deux chambres. Lorsqu'une biomolécule traverse le pore, elle en obstrue une partie plus ou moins importante en fonction de sa taille et des caractéristiques structurales, ce qui entraine une diminution proportionnelle du courant. Cette diminution permet non seulement la détection de la biomolécule, mais constitue une véritable signature structurale de cette dernière dont les caractéristiques peuvent être déduites. Appliquée aux GAGs, cette stratégie a permis la mise en évidence de différentes séquences d’oligosaccharides variant par leur taille (degré de polymérisation), le type d’unités constitutives disaccharidiques, le type de liaisons et les différentes modifications distribuées le long de la chaîne. La discrimination des briques constitutives atteinte dans cette étude publiée dans la revue Nature Communications constitue une étape incontournable vers le séquençage de ces glucides.
Référence
Parisa Bayat, Charlotte Rambaud, Bernard Priem, Matthieu Bourderioux, Mélanie Bilong, Salomé Poyer, Manuela Pastoriza-Gallego, Abdelghani Oukhaled, Jérôme Mathé & Régis Daniel
Comprehensive structural assignment of glycosaminoglycan oligo- and polysaccharides by protein nanopore
Nat. Commun. 2022
10.1038/s41467-022-32800-4