De l’électricité et du nickel pour booster les peptides thérapeutiques
Une équipe de chimiste du laboratoire BioCIS a mis au point une nouvelle méthode de fonctionnalisation des peptides qui utilise un catalyseur au nickel et de l’électricité. Publiée dans la revue Angewandte Chemie International Edition, cette technique douce et biocompatible ouvre de nombreuses perspectives pour le développement de peptides thérapeutiques ou de biomolécules fonctionnelles.
Les peptides, molécules omniprésentes dans nos tissus et cellules, jouent un rôle crucial dans le monde foisonnant de la biochimie. Chaînes d’acides aminés plus courtes que les protéines, ils participent à une multitude de fonctions vitales, de la régulation hormonale à la défense immunitaire. Leur structure unique riche en fonctions chimiques leur confère une affinité et une sélectivité remarquables pour leurs cibles biologiques. Les peptides sont donc des candidats idéaux pour la conception de médicaments innovants et peu toxiques.
Afin de les rendre plus stables ou de contrôler leurs propriétés en les associant à d’autres entités chimiques, les peptides naturels ou synthétiques doivent cependant être fonctionnalisés. Les chimistes organiciens se heurtent ici à un défi de taille : comment fonctionnaliser un acide aminé d’un peptide sans altérer ses autres fonctions chimiques ? Des techniques existent, mais qui requièrent l’usage de métaux rares et coûteux comme le Palladium ou l’Or, ainsi que des conditions réactionnelles peu compatibles avec le milieu biologique.
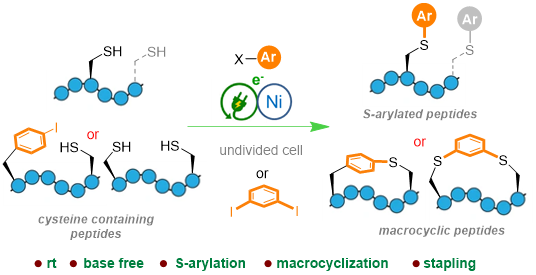
Au laboratoire BioCIS (Biomolécules : conception, isolement, synthèse - CNRS/Université Paris-Saclay/CY Cergy Paris Université), une équipe de chimistes recherche activement des méthodes catalytiques alternatives pour fonctionnaliser les biomolécules complexes (sucres, peptides et protéines) dans des conditions douces. Dans ce contexte, ils ont mis au point une méthode de fonctionnalisation innovante des peptides qui allie catalyse au Nickel et électricité. Simple et biocompatible, cette technique de fonctionnalisation a permis aux scientifiques de greffer des motifs (hétéro)aromatiques sur la cystéine, un des acides aminés des peptides. Si le peptide présente une cystéine à chaque extrémité, cette approche permet même de transformer sa structure linéaire en structure cyclique. Cette cyclisation des peptides est très avantageuse en terme de stabilité car elle permet d’éviter la dégradation par les enzymes dans l’organisme. Ces avancées, publiées dans la revue Angewandte Chemie International Edition, ouvrent un nouvel horizon pour la fonctionnalisation des peptides et, qui sait, à terme, des protéines.
Rédacteur : AVR
Référence
Electrochemical Nickel-Catalyzed Selective Inter- and Intramolecular Arylations of Cysteine Containing Peptides
Linhua Shen, Olivier Monasson, Elisa Peroni, Franck Le Bideau & Samir Messaoudi
Angewandte Chemie International Edition 2023
https://doi.org/10.1002/anie.202315748
