Criblage enzymatique : une nouvelle approche par microfluidique
Optimiser des enzymes pour répondre aux besoins de la recherche et de l’industrie en catalyse nécessite de tester très rapidement les performances des millions de variants. Une équipe de scientifiques a mis au point une nouvelle méthode de criblage par absorbance utilisant la microfluidique, alliant sensibilité inédite et débit record, ouvrant la voie à des avancées majeures en ingénierie enzymatique et plus généralement en criblage biochimique à haut débit.
Les enzymes, catalyseurs essentiels dans de nombreux processus biologiques, sont de plus en plus utilisées dans des processus industriels. Mais leurs performances catalytiques naturelles, façonnées par des milliards d'années d'évolution, ne correspondent que rarement aux besoins spécifiques des laboratoires ou des industriels. D’où l’idée de soumettre ces enzymes à des cycles itératifs de mutations et de sélection afin d’obtenir des variants optimisés qui répondent aux exigences définies par l'utilisateur. Reste ensuite un défi de taille : identifier et trier les variants qui vont nous intéresser au sein de librairies pouvant contenir des millions de séquences.
Les méthodes de criblage conventionnelles qui reposent sur des changements de couleur ou de fluorescence dans des plaques d'agar ou microplaques1 s’avèrent trop lentes pour des bibliothèques aussi volumineuses. La microfluidique apporte une solution élégante et efficace en confinant les réactions dans des micro-gouttelettes de l'ordre du picolitre, permettant un criblage environ deux fois plus rapide que par les approches conventionnelles.
Actuellement, la reconnaissance des enzymes par microfluidique utilise des lectures par fluorescence. Malheureusement, de nombreuses enzymes d’intérêt ne disposent pas de tests de fluorescence adaptés. Il est alors possible de mettre en œuvre ces mesures d’activité catalytique par absorption de la lumière qui, elle, est plus adaptée à un large éventail de tests chromogéniques. Maisà l'échelle micrométrique, la faible absorption de la lumière et la diffusion en surface des gouttelettes limitent fortement la sensibilité de la détection des changements de couleur par absorption et rendent le criblage relativement lent.
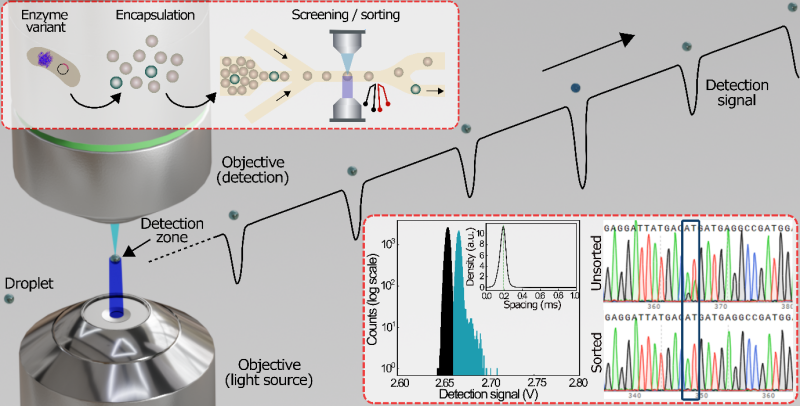
Une équipe du Centre de recherche Paul Pascal (CNRS/Université de Bordeaux) propose donc un système innovant de criblage par absorption « activée » des gouttelettes (cAADS) combinant détection confocale et tri actif. Cette méthode de détection qui met en jeu un diaphragme pour filtrer la lumière à l’entrée du détecteur permet d’améliorer la résolution spatiale (images plus nettes et contrastées). Les scientifiques ont ainsi pu réaliser des mesures d'absorbance d’une sensibilité inédite à un débit ultra-élevé de 5,4 kHz, soit une vitesse 3,6 fois supérieure aux meilleures approches de criblage par absorbance existantes, avec des gouttelettes d’une taille de l’ordre de 10 pL. Cette méthode leur a ainsi permis de sélectionner les variants actifs de la bilirubine oxydase2 avec une efficacité de 99 % et de réaliser le criblage de la glucose oxydase qui catalyse l’oxydation du glucose, démontrant ainsi la polyvalence du système.
Ces résultats publiés dans la revue Adv. Sci. montrent que cette approche se révèle être un outil puissant pour le criblage microfluidique par absorbance, ouvrant de nombreuses perspectives pour l’ingénierie enzymatique et d’autres criblages biochimiques à haut débit.
Rédacteur : CCdM
- 1Ces techniques de criblage utilisent des substrats artificiels ou naturels qui produisent un signal détectable après catalyse enzymatique. L’enzyme modifie le substrat qui libère une molécule susceptible d’absorber de la lumière (chromophore) ou d’en émettre en fluorescent, deux phénomènes facilement mesurables par un spectromètre.
- 2La bilirubine oxydase est une enzyme oxydoréductase qui diminue la toxicité de bilirubine, une molécule issue de la dégradation de l’hémoglobine.
Références
Abdi Mirgissa Kaba, Sébastien Gounel, Thomas Beneyton, Lionel Buisson, Jean-Christophe Baret & Nicolas Mano
Confocal Absorbance-Activated Droplet Sorting (cAADS) for Enzyme Engineering
Adv. Sci. 2025
https://doi.org/10.1002/advs.202505324