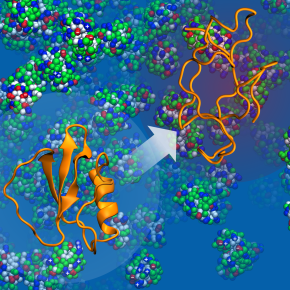
Comment température et encombrement modulent la forme des protéines
Le fonctionnement d’une protéine dépend de sa forme dans l’espace, en particulier de son repliement ou non. Si sa structure n’est pas perturbée quand la protéine est isolée, tout change dans l’environnement encombré d’une cellule. Deux chercheurs du Laboratoire de biochimie théorique (LBT, CNRS) ont découvert que la stabilité structurale d’une protéine dépendait d’un équilibre entre la température, l’espace disponible, la taille des molécules alentour et les interactions de la protéine avec ces dernières. Publiés dans le Journal of Physical Chemistry Letters, ces travaux vont permettre de mieux comprendre la dégradation des protéines, qui pourrait être causée par un manque de stabilité.
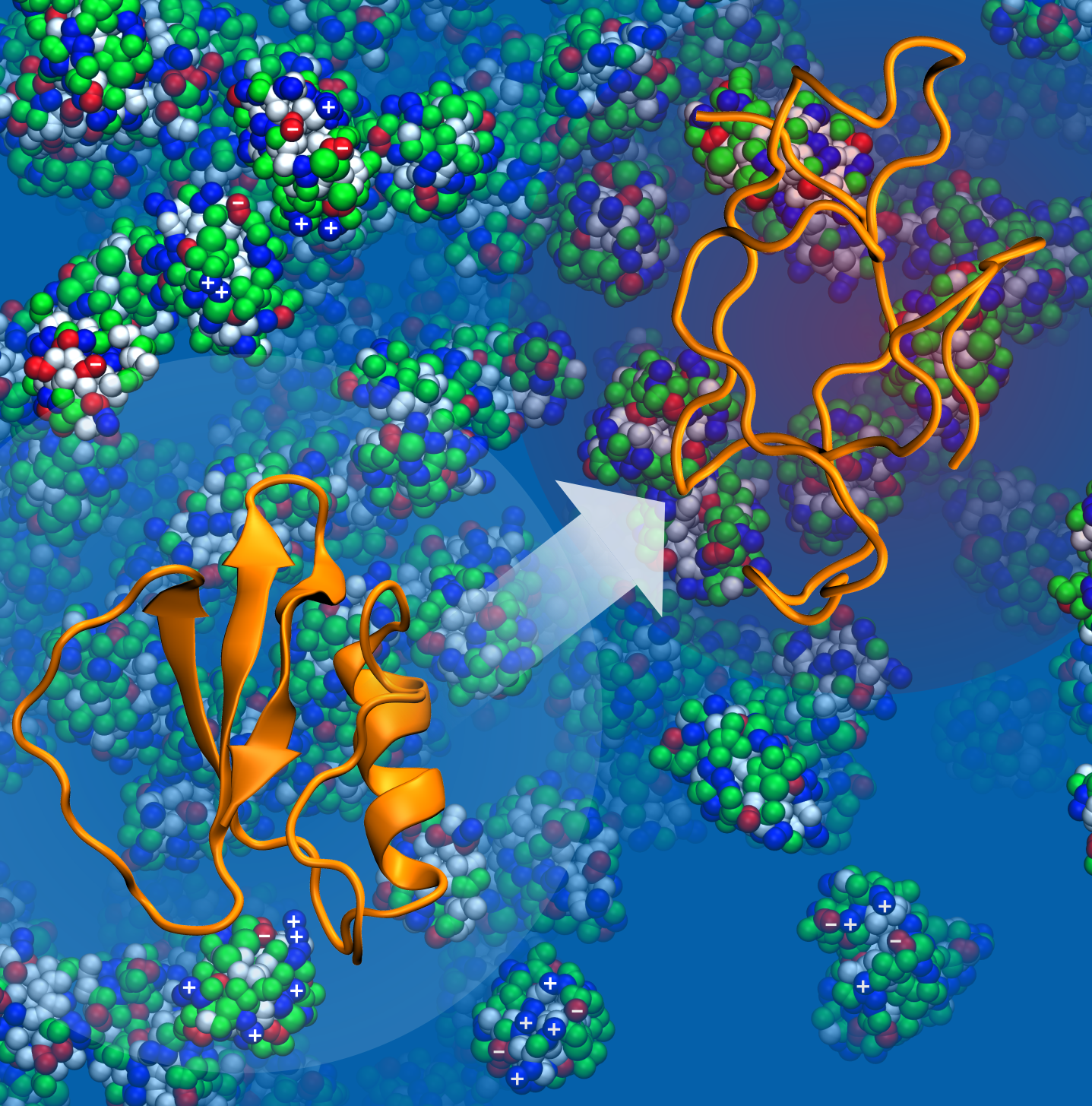
Le fonctionnement des protéines dépend de leur structure en trois dimensions : leurs propriétés changent selon que ces molécules se trouvent dans un état replié ou déplié. Les protéines sont cependant souvent contraintes par l’espace disponible. Ainsi, dans une cellule, 40 % du volume est occupé par d’autres macromolécules. L’encombrement qui en résulte affecte la stabilité de la forme spatiale des protéines. Une molécule isolée, dont la structure n’est pas perturbée par son environnement immédiat, ne réagit pas comme une même protéine qui subit les contraintes d’un espace réduit. La grande question reste de savoir si l’encombrement aide ou empêche les protéines de se stabiliser dans une structure qui optimise leur fonctionnement, un problème important car les pathologies neurodégénératives, telles que les maladies de Parkinson, Charcot, ou encore Alzheimer, sont marquées par une forte instabilité et la dégradation des protéines.
Des scientifiques du Laboratoire de biochimie théorique (LBT, CNRS) ont montré que l’impact de l’encombrement sur la structure des protéines variait en fonction de la température. Dans des conditions ambiantes, les interactions avec les autres molécules perturbent la structure des protéines et sont parfois plus importantes que le confinement spatial. Mais quand la température monte, les interactions déstabilisantes avec les autres molécules deviennent moins importantes. En revanche, la réduction de l’espace disponible due à l’encombrement finit par stabiliser la protéine, par rapport à une molécule isolée, en la contraignant dans une forme pliée. Les coauteurs se sont focalisés sur la protéine CI2 déjà bien documentée par la recherche. Ils ont utilisé des simulations multiéchelles, capables de modifier l’encombrement autour des protéines tout en représentant leurs différentes structures et chacun de leurs atomes. L’énergie libre nécessaire pour que la molécule passe entre l’état plié et l’état déplié a été calculée en fonction de la température. Cette énergie mesure les probabilités relatives de ces deux états, les chercheurs ont ainsi constaté l’existence d’une température critique qui contrôle l’équilibre délicat entre les interactions et le volume disponible, et que cet équilibre dépend également de la taille des macromolécules entourant la protéine. Ces travaux permettront d’explorer les effets d’encombrement macromoléculaire, pour mieux comprendre notamment la mort cellulaire ou, au contraire, comment certaines cellules ne se dégradent pas dans des conditions extrêmes.
Référence
S. Timr, F. Sterpone
Stabilizing or destabilizing: simulations of chymotrypsin inhibitor 2 under crowding reveal existence of a crossover temperature
J. Phys. Chem. Lett. (2021)
https://pubs.acs.org/doi/10.1021/acs.jpclett.0c03626