Chimie quantique : le modèle du continuum diélectrique imaginé par Jean-Louis Rivail et Daniel Rinaldi fête ses 50 ans
En 1973, l’école nancéenne de chimie théorique menée par Jean-Louis Rivail publiait le premier modèle diélectrique permettant à la chimie quantique de prendre enfin en compte les effets du solvant dans les calculs électroniques. Une véritable révolution pour la communauté des chimistes théoriciens qui contribue actuellement à plusieurs milliers de publications chaque année. A l’occasion de ce 50ème anniversaire, dans un article publié dans ChemPhysChem, Manuel Ruiz-Lopez et Jean-Louis Rivail du Laboratoire de physique et chimie théoriques (CNRS/Université de Lorraine) rappellent les origines de ce modèle et montrent combien il est toujours et plus que jamais d’actualité.
- Manuel Ruiz-Lopez, quel a été l’impact, au moment de sa sortie, de cette publication ??
Rappelons d’abord que la majorité des chimistes théoriciens de l’époque étaient focalisés sur l’étude de petites molécules isolées. Les moyens informatiques disponibles ne permettaient en effet pas d’aborder le calcul électronique de systèmes complexes. Ainsi, dans un premier temps, la publication de ce modèle a surtout attiré l’attention des rares théoriciens qui s’intéressaient aux effets du solvant, jusqu’alors pris en compte de façon très rudimentaire (par exemple, en considérant explicitement une seule molécule de solvant interagissant avec le soluté). Mais il faut souligner aussi que l’article a été rédigé en français (avec un résumé en anglais), une pratique courante dans le journal Theoretica Chimica Acta, où l’ on pouvait en outre publier en allemand et même en latin ! Ce fait a sans doute limité l’impact immédiat de la publication de 1973. Ce sera un deuxième article, publié en 1976 (cette fois-ci en anglais dans Chemical Physics) et décrivant une version plus élaborée du modèle, qui lui donnera l'impulsion décisive et incitera d’autres groupes à développer des modèles diélectriques similaires.
- Comment est introduit le solvant dans le modèle diélectrique et quelle est son influence sur le résultat des calculs ?
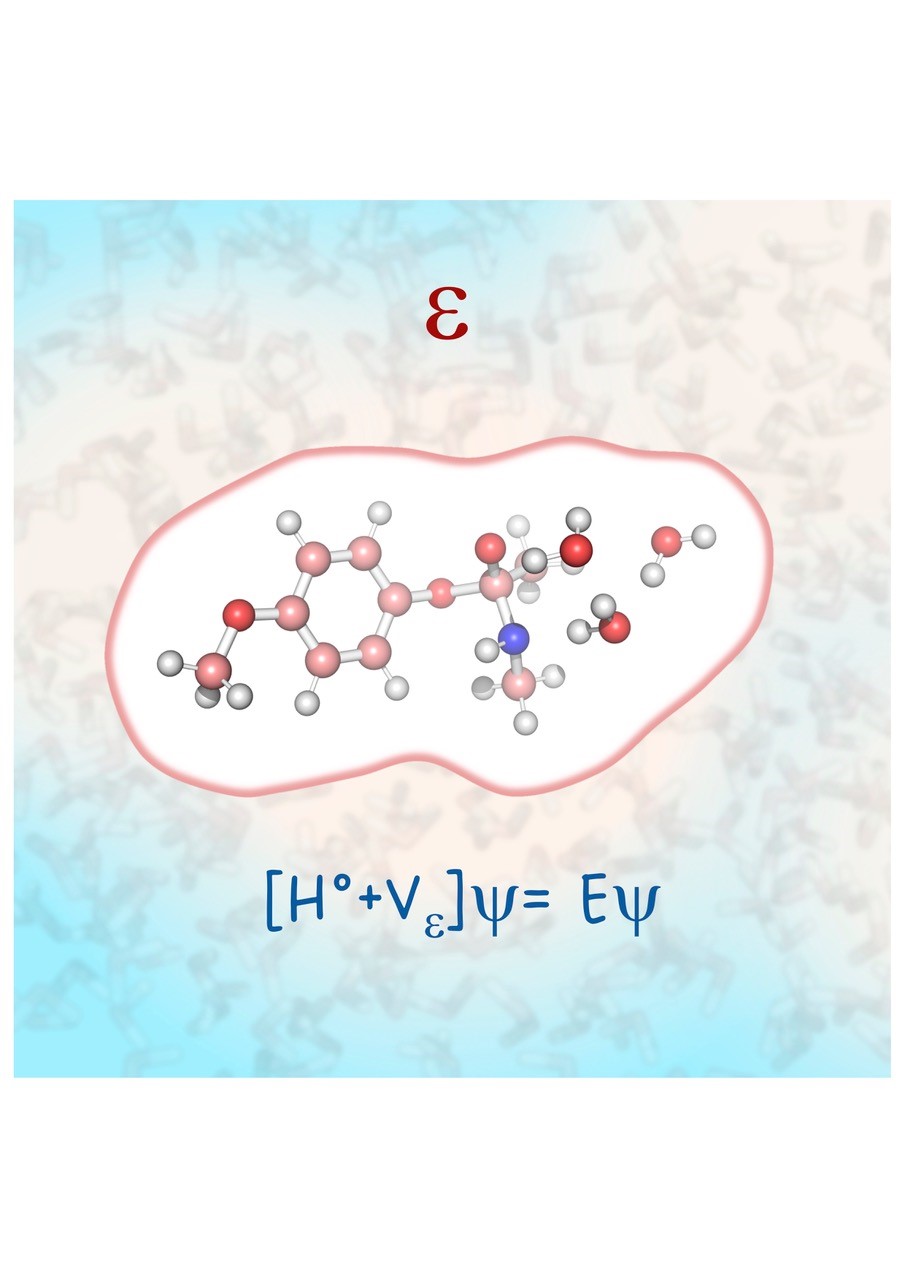
Conceptuellement, le modèle est très simple. Le solvant est représenté par un milieu diélectrique continu entourant le soluté. Ce dernier est supposé être dans une « cavité » créée dans le milieu. En présence des charges électriques portées par le soluté, le milieu diélectrique se polarise. Ceci crée un potentiel électrostatique qui va interagir avec les électrons et les noyaux. L’expression mathématique du potentiel est obtenue en résolvant les équations électrostatiques classiques. Ce potentiel est ensuite ajouté à l’hamiltonien du soluté dont la fonction d’onde peut être calculée par les méthodes habituelles de chimie quantique. Bien entendu, l’introduction du potentiel externe dû au solvant a comme résultat la polarisation à son tour des charges du soluté, ce qui conduit à un système d’équations non-linéaires qui doit être résolu de manière itérative (self-consistent reaction-field equations). La complexité de la machinerie mathématique du problème dépend dans une grande mesure de la forme choisie pour la cavité. Dans le premier modèle de 1973, on a considéré une forme sphérique ou ellipsoïdale, ce qui conduit à une solution analytique du potentiel consistant en une somme de contributions multipolaires. Le cas d’une cavité de forme générale s’ajustant au mieux à la structure de la molécule sera développé plus tard, et fait appel à des calculs numériques. Le grand mérite de ce modèle a été de rendre possible la rationalisation des effets de solvant observés expérimentalement à partir de calculs théoriques de chimie quantique relativement simples. Ces effets modifient parfois de manière très drastique la structure et les propriétés spectroscopiques des solutés, ainsi que leur stabilité. Ils exercent donc une influence majeure sur les équilibres chimiques et la réactivité moléculaire.
- Ce modèle a-t-il évolué depuis sa naissance ? Est-il toujours utilisé et quel est son avenir ?
Le modèle a évidemment beaucoup évolué depuis sa création. Il existe aujourd'hui plusieurs approches, selon la manière dont les équations diélectriques sont résolues et les termes non-électrostatiques estimés. Elles sont disponibles dans la plupart des programmes de chimie quantique et permettent d'effectuer des études en solution de manière routinière. Le modèle continue donc d’être utilisé quotidiennement par un grand nombre de chercheurs. A Nancy, nous nous sommes orientés progressivement vers des modèles de solvant plus élaborés, qui combinent les techniques de chimie quantique et de mécanique statistique. Cette évolution est nécessaire pour décrire les phénomènes de solvatation d’un point de vue dynamique, tout en tenant compte de la structure microscopique du solvant. Cela dit, les approches diélectriques, malgré leurs limitations évidentes, restent extrêmement utiles car le coût additionnel des calculs par rapport à des molécules isolées est assez faible. Ils peuvent donc servir à explorer aisément les problèmes d’intérêt avant de mettre en œuvre, le cas échéant, des techniques plus sophistiquées. Concernant leur avenir, le principal défi sera probablement leur extension à l’étude de milieux non-conventionnels, comme les solvants compatibles avec la chimie verte (solvants eutectiques profonds, liquides ioniques, fluides supercritiques, etc) ou les interfaces. Quelques efforts dans cette direction ont déjà été réalisés mais la route est encore longue.
Rédacteur : CCdM
Référence
Manuel F. Ruiz-López & Jean-Louis Rivail
Quantum Chemistry in Solution. Fiftieth Anniversary
ChemPhysChem 2023
