Chimie de synthèse : vers un meilleur contrôle de la chiralité
Dans un article publié dans la revue Nature Synthesis, des chimistes du CNRS révèlent l’importance des effets d’agrégation du catalyseur sur l’efficacité de la catalyse asymétrique. Cette méthode permet de synthétiser de manière sélective une seule des deux formes d’une molécule chirale. Une étude qui pose un nouveau cadre de réflexion pour le développement de catalyseurs sélectifs et efficaces pour la synthèse de nombreux médicaments, arômes et autres molécules chirales.
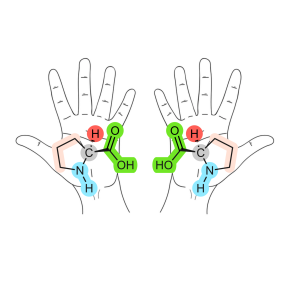
Toute personne qui tente d’enfiler sa main droite dans un gant gauche expérimente la chiralité. Les gants ou les chaussures sont en effet des objets symétriques, images l’un de l’autre dans un miroir, mais non superposables. On dit qu’ils sont chiraux. Il en va de même de nombreuses molécules organiques qui peuvent adopter deux configurations spatiales distinctes, images l’une de l’autre, mais non superposables. Louis Pasteur fut le premier à établir l’origine moléculaire de la chiralité et son importance en chimie du vivant. Depuis, les chimistes n’ont cessé de chercher des méthodes pour obtenir de façon sélective une seule des deux formes, ou un des deux « énantiomères », d’une molécule chirale. Les deux énantiomères peuvent en effet présenter des propriétés et des effets physiologiques complètement différentes : l’un peut être une molécule odorante et l’autre nauséabonde, ou encore l’un peut être un médicament et l’autre un poison.
La synthèse sélective d’un énantiomère est possible par catalyse asymétrique. Cette méthode « énantiosélective » permet de générer une grande quantité d’une molécule chirale uniquement sous une de ses deux formes à partir d’une faible quantité de catalyseur, lui-même chiral. Une large gamme de produits chiraux est devenue accessible grâce à des catalyseurs synthétiques, souvent des complexes métalliques, de plus en plus efficaces. Mais le développement de catalyseurs énantiosélectifs reste un défi pour l’accès à de nombreuses molécules importantes, notamment thérapeutiques.
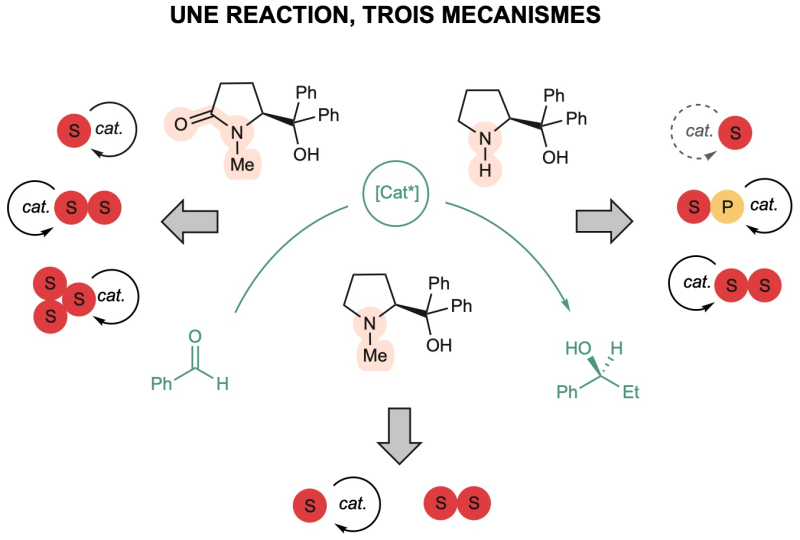
La méthodologie qui vise à obtenir une sélectivité élevée du catalyseur repose sur l'hypothèse que les espèces actives agissent individuellement sur la réaction. L'agrégation du catalyseur dans le milieu réactionnel peut toutefois conduire à un comportement plus complexe que prévu. C’est ce que viennent de montrer des chercheurs de l’Institut de physique et chimie des matériaux de Strasbourg (CNRS/Université de Strasbourg) en revisitant une réaction énantiosélective bien documentée de la littérature : la réaction d’alkylation catalysée par le zinc. Ils ont étudié l'activité de trois ligands dérivés de la proline qui diffèrent par des modifications chimiques mineures sur l’efficacité et la sélectivité du catalyseur à base de zinc. Leur étude révèle des comportements complètement différents pour ces 3 systèmes, caractérisés par de multiples niveaux d'agrégation qui sont simultanément actifs sur le plan catalytique. Ces observations ont été confirmées par des simulations théoriques.
Cette étude, parue dans la revue Nature Synthesis, démontre l’importance de prendre en compte la présence possible de plusieurs espèces actives différentes dans le milieu réactionnel. Comprendre et maîtriser les phénomènes d’agrégation du catalyseur s’avère essentiel pour développer de nouveaux systèmes de catalyse asymétriques efficaces.
Référence
Divergence of catalytic systems in the zinc-catalysed alkylation of benzaldehyde mediated by chiral proline-based ligands.
Thibault Thierry, Yannick Geiger & Stéphane Bellemin-Laponnaz
Nature Synthesis 2024
DOI https://doi.org/10.1038/s44160-024-00491-y