Alzheimer : élucider la formation des agrégats dans le cerveau
Des scientifiques bordelais ont développé une technique de spectroscopie qui permet de visualiser et caractériser chimiquement la formation de fibres amyloïdes. Ces agrégats de la protéine Tau qui apparaissent dans le cerveau sont un des principaux marqueurs de la maladie d’Alzheimer. Cette étape importante dans la compréhension des molécules qui participent à la formation des agrégats pathologiques est parue dans la revue Angewandte Chemie International Edition.
L’agrégation de la protéine Tau dans le cerveau est un marqueur de plusieurs maladies neurodégénératives dont la maladie d'Alzheimer. Des études récentes montrent que la formation de ces agrégats de Tau, aussi appelés fibres amyloïdes, coïncide avec la présence d’autres biomolécules, dont la nature et l’organisation ne sont pas encore élucidées. Identifier in vivo quelles molécules induisent l’agrégation de la protéine Tau et forment les enchevêtrements neurofibrillaires délétères serait une avancée majeure pour la compréhension de la maladie d’Alzheimer et d’autres pathologie associées à la protéine Tau (tauopathies).
In vitro, de nombreuses études ont établi que des molécules chargées négativement, comme des sucres, des lipides ou encore des acides nucléiques (ARN), pouvaient induire l’agrégation de Tau. Mais observer directement pour comprendre quels cofacteurs s’assemblent avec Tau pour former des agrégats pathologiques est une tâche difficile à cause de la taille nanométrique des fibres amyloïdes. Ce défi technologique impose le développement de nouveaux outils de caractérisation.
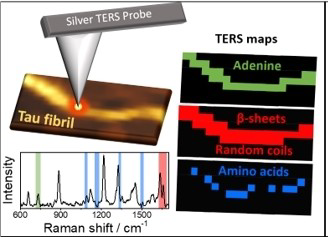
Des équipes bordelaises du laboratoire Chimie et biologie des membranes et des nanoobjets (CBMN, CNRS/Bordeaux INP/Université de Bordeaux) et de l’Institut des sciences moléculaires (ISM, CNRS/Bordeaux INP/Université de Bordeaux) ont démontré que l’agrégation de la protéine Tau peut être induite par l’ARN modèle PolyA, chaîne de nucléotides adénine. Pour ce faire, ils ont eu recours à un montage de spectroscopie Raman TERS (Tip-Enhanced Raman Spectroscopy) développé à l’ISM et qui permet simultanément de visualiser et caractériser chimiquement des agrégats de quelques nanomètres de diamètre. Cette technique de spectroscopie Raman leur a permis d’analyser des fibres amyloïdes individuelles et de révéler l’insertion du PolyA dans la fibre. L’intégration des signatures vibrationnelles spécifiques de la protéine Tau et de l’adénine permet de caractériser simultanément la partie protéique et la partie ARN de la fibre. Cette étude a mis en évidence que l’ARN polyA interagit avec plusieurs régions de la protéine Tau, à la fois celles organisée en feuillet ainsi que ses régions plus désordonnées. De plus, une forte colocalisation est observée entre l’ARN et les résidus chargés positivement de la protéine. Ces résultats, publiés avec le label « hot topic » dans la revue Angewandte Chemie International Edition, permettent de mieux comprendre la formation de ces agrégats pour espérer agir plus en amont sur la pathologie.
Rédacteur: AVR
Référence
Chemical Imaging of RNA-Tau Amyloid Fibrils at the Nanoscale Using Tip-Enhanced Raman Spectroscopy
Gary Sean Cooney, David Talaga, Vicky Ury-Thiery, Yann Fichou, Yuhan Huang, Sophie Lecomte & Sébastien Bonhommeau
Angewandte Chemie International Edition 2023https://doi.org/10.1002/anie.202314369