Braf : le verrou moléculaire que les cellules cancéreuses peuvent forcer
Des scientifiques ont percé le secret de mutations génétiques communes à de nombreux cancers qui activent de manière anarchique une protéine-clé de la division cellulaire : Braf. En visualisant en 3D ces protéines mutantes, ils montrent qu’un médicament en cours de test pourrait inverser l’effet de ces mutations et refermer ce “verrou” défectueux de la division cellulaire.
Dans la machinerie complexe de nos cellules, certaines voies de signalisation sont des autoroutes de l’information, capables de déclencher croissance, division ou repos selon les besoins. L’une de ces voies, baptisée RAS-RAF-MEK-ERK d’après le nom des protéines qui réagissent en cascade pour propager un signal depuis l’environnement extérieur de la cellule jusqu’aux gènes, est habituellement sous surveillance stricte…sauf quand des mutations génétiques viennent saboter ses freins. C’est le cas du gène BRAF, dont certaines versions mutantes sont retrouvées dans près de 8 % des cancers humains, notamment le mélanome.
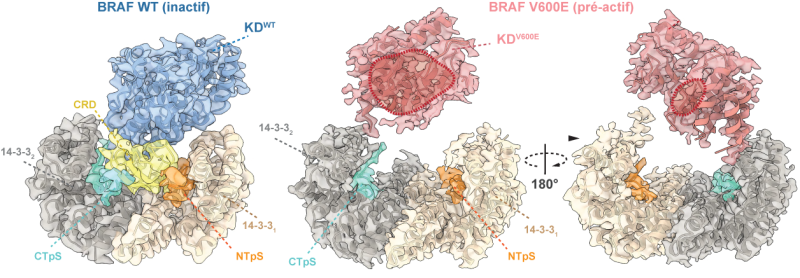
Normalement, la protéine BRAF fabriquée à partir du gène du même nom et qui déclenche sa voie de signalisation, est soigneusement maintenue à l’arrêt, repliée sur elle-même grâce à des interactions internes et bloquée par une autre protéine appelée 14-3-3. Lorsqu’un signal extérieur approprié est détecté, comme un facteur de croissance, cette structure s’ouvre et la protéine BRAF s’active. Mais chez certaines cellules cancéreuses porteuses de mutations, cette activation se produit même sans signal, entraînant la prolifération anarchique des cellules.
Une étude menée dans le cadre d’une collaboration franco-canadienne, entre des scientifiques de l’institut de recherche en immunologie et en cancérologie (Montréal, Canada) et du laboratoire Chimie et biologie des membranes et des nanoobjets (CNRS/Bordeaux INP/Université de Bordeaux), apporte aujourd’hui un précieux éclairage sur les conséquences moléculaires de ces mutations de BRAF. Grâce à une technique d’imagerie de pointe, la cryo-microscopie électronique, ils ont observé la structure tridimensionnelle de plusieurs mutants de la protéine BRAF, dont la plus courante et tristement célèbre V600E. Les observations montrent que la protéine mutante adopte une conformation "pré-active". En d’autres mots, elle est déjà prête à s’activer, comme un interrupteur mal positionné, et cette forme échappe totalement aux mécanismes de blocage et contrôle habituels.
L’étude a également permis de montrer qu’un médicament en cours d’étude, PLX8394, agit comme un ressort de sécurité : il pousse la protéine mutante à reprendre sa forme inactive. Cette propriété pourrait expliquer pourquoi PLX8394 semble plus efficace que d’autres inhibiteurs de BRAF, et préviendrait les mécanismes de résistances aux traitements actuels ciblant BRAF.
Ces résultats, publiés dans Science, ouvrent la voie à de nouveaux traitements mieux ciblés, capables de refermer ce verrou moléculaire accidentellement ouvert chez les patients porteurs de mutations BRAF. À plus long terme, comprendre ces mécanismes communs à plusieurs classes de mutations pourrait améliorer la lutte contre la résistance aux traitements et élargir les options thérapeutiques en oncologie.
Rédacteur : AVR
Référence
BRAF oncogenic mutants evade autoinhibition through a common mechanism
Hugo Lavoie, Ting Jin, Driss Lajoie, Marion Decossas, Patrick Gendron, Bing Wang, Frantisek Filandr, Malha Sahmi, Chang Hwa Jo, Sandra Weber, Geneviève Arseneault, Sasmita Tripathy, Pierre Beaulieu, Doris A. Schuetz, David C. Schriemer, Anne Marinier, William J. Rice, Pierre Maisonneuve & Marc Therrien
Science 2025
DOI: 10.1126/science.adp274