Mieux cibler les virus contre les infections bactériennes
Pour lutter contre les infections bactériennes, on peut utiliser une famille de virus, les bactériophages, capables d’infecter les bactéries de façon ciblée pour mener rapidement à leur destruction. Une équipe du Laboratoire de chimie physique et microbiologie pour les matériaux et l'environnement (LCPME CNRS/Université de Lorraine) a mis au point une nouvelle technique appelée « Spectroscopie de force à particule virale unique » qui leur permet d’identifier les récepteurs à la surface des cellules bactériennes auxquels vont s’accrocher les bactériophages et sans lesquels l’infection des bactéries n’aurait pas lieu. Ces progrès dans la compréhension de ces interactions biologiques complexes devraient aider au développement de la phagothérapie pour le traitement des infections.
Les bactériophages (ou phages) sont des virus susceptibles d’infecter les bactéries de façon ciblée menant ainsi à leur destruction rapide. Ils sont donc au centre des stratégies thérapeutiques développées contre les infections bactériennes (la phagothérapie).
Comme tous les virus, les phages ont besoin d’une cellule hôte pour se reproduire. Ils commencent leur cycle d’infection par la reconnaissance de cette cellule hôte grâce à leurs protéines de surface, les « Receptor-binding protein » (RBP), qui se lient spécifiquement à certains récepteurs extra-membranaires des bactéries. Aucune infection n’est possible sans l’adhésion du phage aux récepteurs de la cellule hôte. La reconnaissance de ces récepteurs susceptibles d’accrocher le virus est donc une étape clé en phagothérapie.
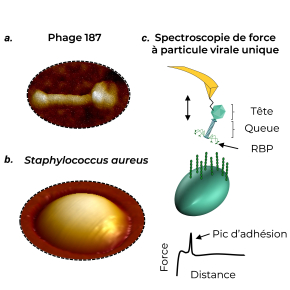
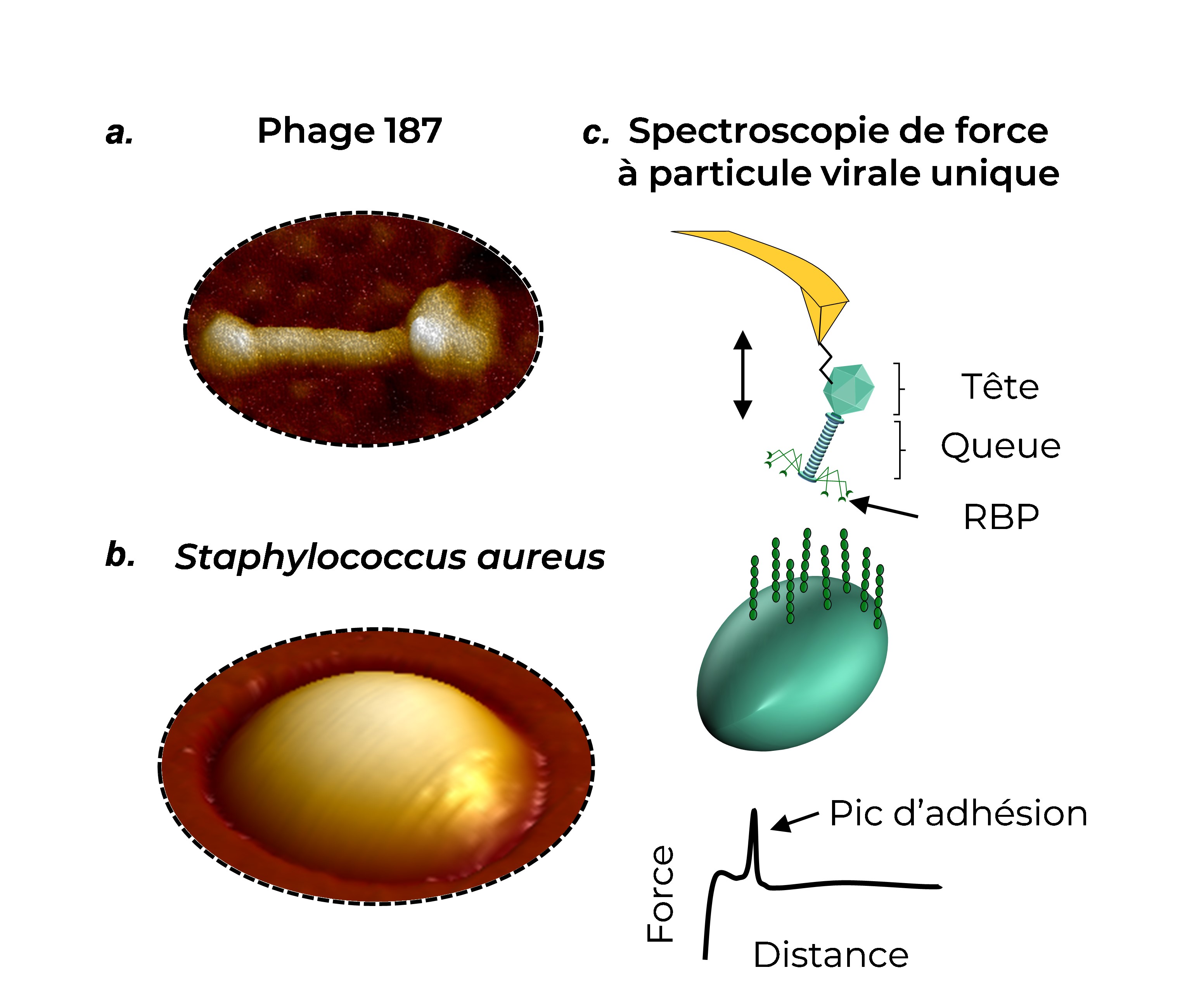
Dans un article publié dans la revue Nano Research, les scientifiques du Laboratoire de chimie physique et microbiologie pour les matériaux et l'environnement (LCPME CNRS/Université de Lorraine) décrivent comment ils ont utilisé la microscopie à force atomique (AFM) pour caractériser, à l’échelle nanométrique, les interactions qui gouvernent l’infection bactérienne par les phages. Grâce à leur méthode appelée « Spectroscopie de force à particule virale unique », ils ont identifié le N-acétylglucosamine comme étant le récepteur clé de l’interaction entre le phage 187 (Figure 1a) et le staphylocoque doré (Staphylococcus aureus) (Figure 1b).
Cette nouvelle méthode d’analyse (Figure 1c) offre une meilleure compréhension des interactions biologiques complexes des phages avec les bactéries hôtes, indispensable si l’on veut identifier de nouveaux phages pour des traitements toujours plus efficaces.
Rédacteur : CCdM
Référence
Baptiste Arbez, Marion Gardette, Christophe Gantzer, Neus Vilà, Isabelle Bertrand & Sofiane El-Kirat-Chatel
Deciphering the role of monosaccharides during phage infection of Staphylococcus aureus
Nano Research 2022