Après un siècle d’attente, un premier modèle de la libération des gaz par l’hémoglobine
Les hémoglobines transportent des gaz tels que le dioxygène dans le corps. Alors que leur rôle est connu depuis un siècle, le détail du processus restait mal compris à cause de réactions trop rapides pour être observées. Des chimistes de l’Institut de chimie radicalaire (CNRS/Aix-Marseille Université) et des universités de Frankfort et de Tokyo ont proposé un premier modèle théorique expliquant le phénomène. Ces travaux, publiés dans Nature Communications, remettent en cause le déroulement jusque-là supposé de la réaction.
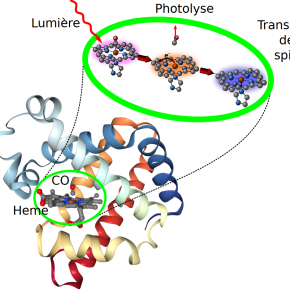
Les hémoglobines, des protéines contenant du fer, sont essentielles à la vie puisqu’elles transportent dans le corps des molécules gazeuses telles que le dioxygène des poumons aux organes. Si on sait que les gaz s’y accrochent grâce au fer et que la lumière les fait relâcher, l’opération de l’association et dissociation des molécules de gaz reste mystérieuse depuis plus d’un siècle. Mettant fin à cette longue interrogation, des chercheurs de l’Institut de chimie radicalaire (ICR, CNRS/Aix-Marseille Université) et des universités de Frankfort et de Tokyo ont conçu le premier modèle théorique de libération du gaz par des hémoglobines.
Leur modèle est basé sur le monoxyde de carbone (CO) et le centre actif de la myoglobine. Cette molécule, qui assemblée par groupes de quatre forme une hémoglobine, fonctionne de la même manière, à la différence qu’elle transporte des gaz dans les tissus musculaires. Se produisant en seulement quelques dizaines de millionièmes de milliardièmes de seconde, la première étape du relâchement d’un gaz ne peut toujours pas être observée, y compris avec des technologies laser de pointe. Ce modèle fournit malgré tout des estimations correctes des phases suivantes, qui sont en revanche observables. Alors que le monde de la recherche s’attendait plutôt à ce que la libération des gaz soit provoquée par un changement d’état magnétique du fer, ces travaux montrent l’inverse : les atomes de fer changent d’état après le départ du gaz. Ces travaux remettent en cause le paradigme de la photochimie des complexes organométalliques de fer et pourront inspirer un réexamen critique de ces mécanismes de manière plus générale.
Référence
Konstantin Falahati, Hiroyuki Tamura, Irene Burghardt et Miquel Huix-Rotllant
Ultrafast carbon monoxide photolysis and heme spin-crossover in myoglobin via nonadiabatic quantum dynamics.
Nature Communications – Octobre 2018
DOI: 10.1038/s41467-018-06615-1